硫氰
化合物
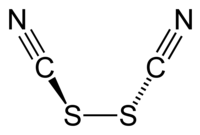
硫氰化學式為(SCN)2,是一种黄色液体,在常温下可以分解,是一种拟卤素。硫氰的空間對稱群為C2,其結構可表示為NCS-SCN[1]。硫氰的氧化能力比溴要大,會和水反應;[2]
| 硫氰 | |
|---|---|
 | |
 | |
 | |
| 识别 | |
| CAS号 | 505-14-6 |
| PubChem | 68160 |
| ChemSpider | 61468 |
| SMILES |
|
| InChI |
|
| InChIKey | DTMHTVJOHYTUHE-UHFFFAOYAE |
| ChEBI | 30063 |
| 性质 | |
| 化学式 | C2N2S2 |
| 摩尔质量 | 116.16 g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
- 3 (SCN)2 + 4 H2O → H2SO4 + HCN + 5 SCN− + 5 H+
硫氰最早是由硫氰酸银与碘在乙醚中制得[3],但由於碘的氧化性弱,此反應最後會達到平衡,產率不佳。硫氰也可以由硫氰酸鉛和Br2反应产生,而硫氰酸鉛可以由硝酸鉛和硫氰酸鈉混合而成。可以用無水的硫氰酸鉛和溴在冰醋酸中反應[4]。另一種方法是將溶於二氯甲烷中的溴滴入懸浮在0℃二氯甲烷的硫氰酸鉛中,之後再用氬氣保護,會生成硫氰的溶液,但製備的硫氰需立刻使用[5]。
- Pb(SCN)2 + Br2 → (SCN)2 + PbBr2
硫氰會和烯類產生加成反應,生成有1,2-二(硫氰)結構的化合物。硫氰也會和二茂钛杂环戊二烯(titanacyclopentadiene)反應,最後生成1,2-二噻烯(1,2-dithiins)。硒氰化學式為(SeCN)2,可以由硒氰酸银和碘在0度的四氢呋喃中反應制得[6],其反應和硫氰類似[5]。另外,硫氰能与硝酸反应,产生氢氰酸,一氧化氮,硫酸等;或被彻底氧化成CO2,NO2,SO3等气体。制备硫氰也可以用硫氰化钾与碘发生置换反应,产生硫氰。