固氧
固氧、固态氧形成于正常大气压的54.36K(-218.79°C)以下。固态的氧气由于吸收红色光,像液氧一样,是浅蓝色透明物质。氧分子因它在分子磁化(molecular magnetization)上与晶体结构、电子排布、超导电性的关系而受到关注。氧分子是能承载磁矩的唯一的简单双原子分子(通常情况下纵使所有分子也只有少数能够如此)[1]。它被认为是“受自旋控制(spin-controlled)”的晶体[1],并因此展现出不寻常的磁性规律[2]。在极高压下,固氧从热绝缘材料变成金属的形态[3];而在极低温下,它甚至能变成超导体[4]。对固氧的结构研究始于19世纪20年代,目前,已确定六种明确的晶体相[1]。
固氧的密度从α相的约21 cm3/mol,到γ相的约 23.5 cm3/mol 。固氧的摩尔质量 来自美国国家标准技术研究所
相变

- α相:浅蓝色,正常大气压下生成于23.8K以下,单斜晶系。
- β相:微弱的蓝色至粉红色,正常大气压下生成于43.8K以下,三方晶系。(室温高压下变为O
4) - γ相:微弱的蓝色,正常大气压下生成于54.36K以下,等轴晶系。
- δ相:橙色,室温下施加9GPa(9千兆帕斯卡)以上的压强时生成。
- ε相:深红色至黑色,室温下施加10GPa以上压强时生成。
- ζ相:金属,在96GPa以上压强生成。
已知室温下给氧气施加压强时,它会凝固成叫做β相的物态。继续加大压强后,9GPa时,β相相变为δ相,10GPa时变为ε相。同时,随着分子间斥力的增大,β相的颜色从粉红到橙色,再到红色(稳定的O
8形式),红色随压强增大而逐渐变深直至黑色。96GPa下ε相出现后继续压缩,将出现金属形式的ζ相。[5]
红氧
随着室温下氧气的压强超过10GPa,它将出人意料地相变为另一个同素异形体。它的体积骤减[6],颜色也从蓝变成深红[7]。这种ε相发现于1979年,但当时它的结构并不清楚。基于它的红外线吸收光谱,1999年,研究人员推断此相态是O
4分子的晶体[8]。但在2006年,X射线晶体学表明这个被称作ε氧或红氧的稳定相态实为O
8[9][10]。此结构在理论上不曾被预测[5]:由四个O
2分子组成的菱形的O
8原子簇[11]。
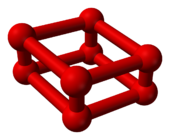 |  |
8 的球棒模型 |
所有相态中,这个相态相当有趣。它颜色为深红色,对红外线吸收能力很强,并有磁场缩灭(magnetic collapse)[1]。它在很大的压强范围内(10GPa至96GPa)稳定,已成为许多X射线衍射、光谱学和理论学者的课题。
金属氧
ε相的氧被继续压缩后,出现了ζ相[6]。这种相态在1990年,给氧气施加132GPa压强时也出现了[3]。已知金属的、簇状的ζ相[13]在低温下表现出超导性[4][5]。