吡咯
| 吡咯 | |||
|---|---|---|---|
| |||
| |||
 | |||
| IUPAC名 1H-Pyrrole 1H-吡咯 | |||
| 别名 | 唑[1] 氮雜茂 | ||
| 识别 | |||
| CAS号 | 109-97-7 | ||
| PubChem | 8027 | ||
| ChemSpider | 7736 | ||
| SMILES |
| ||
| InChI |
| ||
| Beilstein | 1159 | ||
| Gmelin | 1705 | ||
| UN编号 | 1992, 1993 | ||
| EINECS | 203-724-7 | ||
| ChEBI | 19203 | ||
| RTECS | UX9275000 | ||
| 性质 | |||
| 化学式 | C4H5N | ||
| 摩尔质量 | 67.09 g·mol⁻¹ | ||
| 密度 | 0.967 g/cm3 | ||
| 熔点 | −23 °C | ||
| 沸点 | 129–131 °C | ||
| 热力学 | |||
| ΔfHm⦵298K | 108.2 kJ mol–1 (气态) | ||
| ΔcHm⦵ | 2242 kJ mol–1 | ||
| 热容 | 1.903 J k–1 mol–1 | ||
| 危险性 | |||
| NFPA 704 | |||
| 闪点 | 33.33 °C | ||
| 自燃温度 | 550 °C | ||
| 爆炸極限 | 3.1–14.8% | ||
| 相关物质 | |||
| 相关化学品 | 吲哚,呋喃,噻吩,吡啶 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
歷史
1857年,它從骨頭的熱解物中分離出來。它的名字來自希臘的pyrrhos(πυρρός,“微紅,火熱”),來自用來檢測它的反應—當它被鹽酸浸濕後賦予木材紅色。[5]
性质与反应
酸碱性
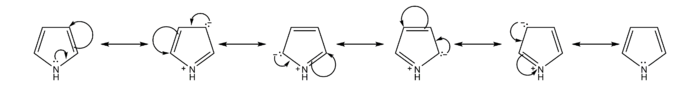
吡咯碱性较其它胺类弱,其共轭酸的pKaH约为–1到–2。这是因为氮原子上的一对电子与两个双键上的电子形成离域体系(Π56)。正因为如此,吡咯有芳香性,形成共轭酸后芳香体系被破坏,故吡咯氮不易结合质子。
吡咯有微弱酸性,其pKa为16.5。用正丁基锂和氢化钠之类的强碱处理吡咯得其负离子,与亲电试剂如碘甲烷反应得N-甲基吡咯。
芳香性
与苯和其它五元杂环化合物比较,亲电取代反应活性吡咯>呋喃>噻吩>苯。吡咯亲电取代反应反应活性非常高,例如吡咯在氢氧化钠作用下与碘反应生成四碘吡咯。[6]这是由于吡咯π电子雲密度高于苯,且碳正离子中间体非常稳定。吡咯硝化不宜直接使用硝酸,因易被氧化,常使用温和的非质子试剂硝酸乙酰酯;磺化也避免使用硫酸,常用吡啶与三氧化硫加合物作磺化试剂。[7]
吡咯亲电取代反应α位活性更高,可通过曼尼希反应或Vilsmeier-Haack反应从吡咯制备α位上有取代基的衍生物。[8]
吡咯与醛缩合得卟啉环,如苯甲醛与吡咯反应,冷凝得四苯基卟啉。对于取代吡咯,如已有基团为邻对位定位基,第二个基团进入相邻α位;如为间位定位基,则进入间位α位。[7]
聚合
吡咯在浓酸中树脂化,在冷的稀酸或三氯化铁的甲醇溶液中聚合,得到导电化合物聚吡咯。[6]
- n C4H4NH + 2 FeCl3 → (C4H2NH)n + 2 FeCl2 + 2 HCl
氧化
与其它胺一样,吡咯在空气中和光照下氧化变黑,生成聚吡咯和多种胺氧化物。因此吡咯使用前需要蒸馏。[9]
- 蒸馏不纯的吡咯
- 得到无色透明的馏分
D-A反应
吡咯在一定条件下例如路易斯酸催化,或加热,高压而作为双烯体参与D-A反应。
鉴定
合成
以氧化铝为催化剂,在氨的作用下可从呋喃和噻唑合成吡咯。这个反应名为Yurev合成,可实现吡咯、呋喃、噻吩环系的互变。[7]
另一种方法是由半乳糖二酸的铵盐脱水制得。通常用甘油作溶剂,加热半乳糖二酸铵,蒸出生成的吡咯。[11]
取代吡咯的合成
取代吡咯有多种合成方法,较经典的有Knorr吡咯合成,Hantzsch吡咯合成与Paal-Knorr合成。
Piloty–Robinson吡咯合成使用肼和2倍当量的醛做原料,[12][13]合成3,4位上具有特定取代基的吡咯。 反应生成二亚胺中间体(R–C=N−N=C–R),然后在盐酸作用下重排,失去一分子氨关环得取代吡咯。
在上述反应的第二步发生了[3,3]σ迁移。
相关条目
- 吡咯尿症
- 四吡咯