రేడాన్
| దస్త్రం:Radon.jpg | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| రేడాన్ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Pronunciation | /ˈreɪdɒn/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Appearance | colorless gas, occasionally glows green or red in discharge tubes. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mass number | [222] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| రేడాన్ in the periodic table | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Group | మూస:Infobox element/symbol-to-group/format | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Period | period 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Block | p-block | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electron configuration | [Xe] 4f14 5d10 6s2 6p6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrons per shell | 2, 8, 18, 32, 18, 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Physical properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phase at STP | gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Melting point | 202 K (−71 °C, −96 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Boiling point | 211.5 K (−61.7 °C, −79.1 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Density (at STP) | 9.73 g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| when liquid (at b.p.) | 4.4 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Critical point | 377 K, 6.28[1] MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of fusion | 3.247 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Heat of vaporization | 18.10 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar heat capacity | 5R/2 = 20.786 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Vapor pressure
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomic properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidation states | 0, +2, +6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegativity | Pauling scale: 2.2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionization energies |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Covalent radius | 150 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 220 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Other properties | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Natural occurrence | from decay | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Crystal structure | face-centered cubic (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thermal conductivity | 3.61×10−3 W/(m⋅K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetic ordering | non-magnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS Number | 10043-92-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| History | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Discovery | Friedrich Ernst Dorn (1898) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| First isolation | William Ramsay and Robert Whytlaw-Gray (1910) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes of రేడాన్ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Template:infobox రేడాన్ isotopes does not exist | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
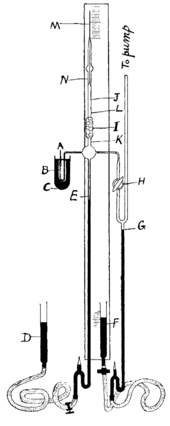
2 entered the evacuated system through siphon A; mercury is shown in black.
ప్రాథమిక సమాచారం
రేడాన్ ఒకరసాయనిక మూలకం.ఇది సాధారణ ఉష్ణోగ్రత వద్ద వాయురూపంలో లభించు మూలకం.మూలకాల ఆవర్తన పట్టికలో 18 వసముదాయము, p బ్లాక్,6 వ పిరియడ్ కు చెందిన వాయువు.[2] ఈ మూలకం యొక్క పరమాణు సంఖ్య 86[3]. మూలకం యొక్క రసాయనిక సంకేత అక్షర Rn. ప్రకృతిలో స్వాభావికంగా లభిస్తుంది.రేడాన్ ఒక జడవాయువు[4], 18వ సముహానికి చెందిన మూలకాలను జడవాయువులు లేదా నోబుల్ గ్యాసెస్ అంటారు (ఇవి హీలియం, నియాన్, ఆర్గాన్, క్రిప్టాన్, జెనాన్,, రేడాన్). రేడాన్ రేడియో ధార్మికత కలిగిన, రంగులేని, వాసనలేని, రుచిలేని వాయువు.[5] ఇది అరుదైన వాయు మూలకం.
చరిత్ర
కనుగొనబడిన రేడియో ధార్మికత కలిగిన మూలకాలలో రేడాన్ అయిదవ మూలకం.ఈ మూలకాన్ని 1900 లో ఫ్రెడరిక్ ఎర్నెస్ట్ డొర్న్ (Friedrich Ernst Dorn) కనుగొన్నాడు. ఫ్రెడరిక్ ఎర్నెస్ట్ డొర్న్ తన పరిశోధనలలో రేడాన్ సమ్మేళనాలు రేడియో ధార్మికత కలిగిన వాయును విడుదల చెయ్యడం గమనించి దానికి రేడియం ఎమనేసన్ (Radium Emanation ;Ra Em) అని నామకరణం చేసాడు[4][5].రేడాన్ కన్న ముందుగా గుర్తించిన కనుగొన్న రేడియోధార్మికత కలిగి మూలకాలు యురేనియం, థోరియం, రేడియం, పొలోనియం.
అంతకు ముందే 1899 లో క్యూరీ దంపతులు రేడియం నుండి వెలువడిన వాయువు ఒకనెల రోజులపాటు రేడియో ధార్మికత గుణాన్ని కలిగి ఉండటం గమనించారు. అదే సంవత్సరం మోం ట్రియాల్ లోని మెక్ గిల్ యునివర్సిట్ లో పరిశోధనలు చేస్తున్న Robert B. Owens, Ernest Rutherford లు థోరియం ఆక్సైడ్ యొక్క ధార్మికతను విలువను కొలుస్తున్నప్పుడు, హెచ్సుతక్కువ విలువలు రావడం గుర్తించారు[4]. రూథర్ ఫోర్డ్ థోరియం సమ్మేళనాలు నిరంతరంగా రేడియో ధార్మికత కలిగిన వాయును విడుదల చేస్తుండటం, అది కొన్ని నిమిషాలపాటు రేడియో ధార్మికత శక్తిని ప్రసరణంచెయ్యడం గమనించాడు.ఆయన ఈ వాయువుకు మొదట emanation (Latin LO "emanare"— గతించు, "emanatio"— సమాప్తి, అని పేరు పెట్టాడు. తరువాత థోరియం ఎమనేసన్ (Th Em) గా మార్చాడు.1901 లో వాయువు యొక్క నిర్గమన (emanations) రేడియో ధార్మికత ప్రదర్శించి నిరూపించాడు, అయితే ఈ మూలకాన్ని కనుగొన్న గౌరవము క్యూరి గారిదిగా పేర్కొన్నాడు.
.1903 లో ndré-Louis Debierne కుడా ఆక్టినియం కుడా ఇదే తరహాలో రేడియో ధార్మికత కలిగిన నిర్గమనం/ప్రసరణము (Emanation) గుర్తించాడు, దీనికి ఆయన Actinium Emanation (Ac Em).అని పేర్కొన్నాడు.1904 లో సర్ విలియం రామ్సే నిర్గమనం/ప్రసరణము (emanation) ఒక కొత్త జడ వాయువు/నోబుల్ వాయువు వలన అయ్యి ఉండవచ్చునని ప్రతిపాదించాడు. 1910 లో సర్ విలియం రామ్సే, రాబర్ట్ వైట్ లా –గ్రేలు రేడాన్ను వేరుచేసి, దాని సాంద్రతను నిర్దారణ చేసి, అప్పటికి వరకు తెలిసిన వాయువులలో భారమైన వాయువు అనినిర్ధారించారు..
ఉనికి
వాతావరణంలో ఉండు రేడాన్ గాఢతను సాధారణంగా బెక్వేరెల్ యూనిట్లులలో (బెక్వెరల్/ఘన మీటరు) కొలిచెదరు[6]. మరొక మాపక విధానం పిక్కోరిస్ /లీటరు (PCi/L). రేడాన్ యొక్క రేడియోధార్మికత ప్రభావం సరాసరిన ఇళ్ళలో 48 Bq/m3, బయలు ప్రదేశాలలో15 Bq/m3 వరకు ఉండును.
స్వాభావిక లభ్యత
స్వాభావికంగా రేడాన్ వాయువు, యురేనియం ఖనిజాలలో, పాస్ఫేట్ శిల, నాపరాయి, అగ్నిశిలలు[5], రూపాంతర శిలలు (గ్రానైట్, పలకలుగా చీలుఅభ్రకమువంటి ఱాయి, తక్కువ పరిమాణంలో అయిన్నప్పటికి సున్నపురాయి వంటి, మాములుసాధారణ రాళ్ళల్లో ఉండు రేడియం-226 ఐసోటోపు యొక్క అణుధార్మిత క్షయికరణ వలన ఉత్పన్నమగుచున్నది. భుమౌపరితలం మీద 15 సెం.మీ లోతు x2.5 చదరపు కిలోమీటర్ల వైశాల్యంలో అందాజుగా ఒక గ్రాము రేడాన్ ఉండి, అది నెమ్మదిగా వాతావరణంలోనికి విడుదల అవుచున్నది. ప్రపంచం మొత్తంమీద 2,400 మిలియను క్యూరిస్ (90 TBq) ల రేడాన్ నేలలోని మన్ను నుండి గాలిలోనికి విడుదల అగుచున్నది.
అయితే ప్రదేశాన్ని బట్టి రేడాన్ యొక్క గాఢత మారుతుంది, బయలు ప్రదేశంలోని గాలిలో 1-100 Bq/m3, సముద్ర ఉపరితలం పైన 0.1 Bq/m3. గుహాలలో, గాలి ప్రసారమున్న గనులలో, గాలి ప్రసరణ సరిగా లేని ఇళ్ళలో, రేడాన్ యొక్క గాఢత 20 నుండి 2,00 0 Bq/m3 ఉండును.రేడాన్ ఎక్కువగా యురేనియం శ్రేణికి చెందిన (222Rn,, థోరియం శ్రేణికి చెందిన (220Rn) ల గొలుసు క్షయికరణ ఫలితంగా రేడాన్ ఆవిర్భవిస్తుంది.[7] ఈ మూలకం స్వాభావికంగా ప్రపంచవ్యాప్తంగా యురేనియం లేదా థోరియం ఆనవాళ్ళు గల నేలనుండి, భవన నిర్మాణ పదార్థాలనుండి[7] వెలువుడును.
కొన్ని ఊటనీరు బుగ్గలలోని (springs, వేడి ఊటనీరు బుగ్గలలోని నీటిలో ఎక్కువ పాళ్ళలో రేడాన్ ఉండటం గమనించవచ్చును. జర్మనీ దేశానికి చెందిన బౌల్డర్, మోంటానా, మిసాస నగరపు ఉట బుగ్గలలో,, జపాను దేశానికి చెందిన ఊటనీరు బుగ్గలనీటిలో అధిక పాళ్ళలో/మోతాదులో రేడాన్ మూలకం ఉంది. భూ ఉపరితల జలాలలో కన్న భూగర్భ జలాల్లో 222Rn ఐసోటోపు ఎక్కువ మోతాదులో ఉండును. భూగర్భం రాళ్ళలో ఉండు 226Ra ఐసోటోపు నిరతంత క్షయికరణ వలన రేడాన్ నిరతంరం జనిస్తున్నే ఉండుటచే, భూగర్భ జలాలలో రేడాన్ ఉనికి అధికం[7].
భౌతిక ధర్మాలు
రేడాన్ రంగులేని, వాసనలేని,, రుచిలేని మూలకం, అందువలనమాములుగా మానవ ఇంద్రియ జ్ఞానంతో గుర్తించడం కాస్త కష్టసాధ్యమైన పని.ప్రామాణిక ఉష్ణోగ్రత, పీడనం వద్ద ఏక పరమాణువు సౌష్టవం కలిగిన రేడాన్ యొక్క సాంద్రత 9.73 కిలోలు /మీ3.[3] ఇది భూవాతావరణం కన్న 8 రెట్లు ఎక్కువ (సముద్ర మట్టం వద్ద, సాధారణ పరిస్థితులలో వాతవరనంలోని వాయువుల సాంద్రత 1.217 కిలోలు /మీ3).సాదారణ గది ఉష్ణోగ్రత వద్ద ఎక్కువ సాంద్రత కలిగిన వాయువు రేడాన్, అంతే కాదు, తోటి జడవాయువుల (నోబుల్ గ్యాసెస్ ) కన్నకుడా బరువైన వాయువు.రేడాన్ రంగు లేని వాయువు అయినప్పటికీ ఘనీభవస్థానం 202K (-71 °C) కన్న తక్కువ ఉష్ణోగ్రతకు తగ్గించి ఘనరూపానికి తెచ్చిన, రేడాన్ ప్రకాశవంతమైన అణుధార్మికత దీప్తిని ( radioluminescence ) విడుదల చేయును, ఉష్ణోగ్రత తగ్గేకొలది పసుపు వర్ణంనుండి ఆరెంజి-ఎరుపు రంగుకు మారును[2]. నీటిలో రేడాన్ చాలా తక్కువ పరిమాణంలో కరుగును, కాని మిగతా తేలికైనజడవాయులలో పోల్చిన, వాటికన్నాకాస్త ఎక్కువ నిష్పత్తిలోకరుగును
రసాయనిక ధర్మాలు
జడ వాయువులు/నోబుల్ వాయువులు రసాయనికంగా రసాయనిక చర్యలలో అంత చురుకుగా పాల్గొనవు. జడవాయువులు/నోబుల్ గ్యాసెస్ శూన్య బంధ శక్తి (zero–valance) కలిగిన మూలకాలు.అందుచే ఇవి చాలా రసాయనిక చర్యలలో చురుకుగా పాల్గొనని కారణం వలననే వాటిని జడ (inert) వాయువులు లేదా నోబుల్ గ్యాసెస్ (noblegases ) అంటారు. వీటి పరమాణు బయటి వలయంలో 8 ఎలక్ట్రానులు ఉండి, స్థిరమైన, కనిష్ఠ సమగ్రాకృతి/రూపరేఖ (configuration) వలన బయటి వలయంలోఎలక్ట్రానులు, బలిష్టంగా గట్టిగా బంధనం కలిగియుండును.అందుచే బయటి వాటితో అంత చురుకుగా రసాయనిక చర్యజరుపవు.రేడాన్ కుడా నోబుల్/జడ వాయువుల సముదాయానికి చెందిన వాయు మూలకం కావున ఇదికూడా రసాయనికంగా అంత చర్యా శీలతను ప్రదర్శించదు.
రేడాన్ను ఫ్లోరిన్వంటి బలమైన ఆక్సీకరణ కారకంతో ఆక్సీకరించడం వలన రేడాన్ డై ఫ్లోరైడ్ ఏర్పడును .ఈ సమ్మేళనం 250 °C వద్ద పునః రేడాన్ మూలకంగా వియోగం చెందును. రేడాన్, దాని సమ్మేళనాలు తక్కువ అర్ధ జీవితం కలిగియుండుట వలన, వీటి ధర్మాల, లక్షణాల గురించి విస్తృతంగా తెసుకోను అవకాశం కలుగలేదు.అందువలన సిద్దాంత పరమైన అంచనాలప్రకారం రేడాన్ –ఫ్లోరిన్ బంధ దూరం 2.08 A ఉండునని నిర్దారించారు. ఈ సమ్మేళనం తన కంటే తేలికైన సమ్మేళనము XeF2 కన్న, థెర్మో డైనమికల్గా ఎక్కువ స్థిరమైనది, తక్కువ వోలటైల్ గుణం (అతితక్కువ ఉష్ణోగ్రత వద్ద త్వరగా ఆవిరిగా మారు లక్షణం ) కలిగినది అని అంచనా.
అష్టభుజ అణుసౌష్టవం కలిగిన RnF6 సమ్మేళనం, రేడియం డై ఫ్లోరైడ్ కన్న తక్కువ enthalpy కలిగియుండునన్ని అంచనా.
[RnF]+ అయాను ఈ దిగువన సూచించిన చర్యానుగుణ్యంగా ఏర్పడును.
- Rn (g) + 2 [O
2]+
[SbF
6]−
(s) → [RnF]+
[Sb
2F
11]−
(s) + 2 O
2 (g)
తెలిసిన రేడాన్ యొక్క తక్కువ సమ్మేళనాలో, ఆక్సైడు సమ్మేళనాలు కొన్ని.రేడాన్ ట్రైఆక్సైడు ఉనికిని మాత్రం నిర్ధారించారు.రేడాన్ కార్బోనిల్ (RnCO) సమ్మేళనం స్థిరత్వముకలిగి, నిడుపైన అణుజ్యామితి (linear molecular geometry) కలిగి ఉండునని ఉహిచడమైనది.
ఐసోటోపులు
రేడాన్కు స్థిరమైన ఐసోటోపులు లేవు. పరమాణు ద్రవ్యరాశి 193-228 మధ్య కలిగిన 36 రేడియోధార్మికత కలిగిన ఐసోటోపులను గుర్తించడం జరిగింది.వీటిలో కాస్తఎక్కువ స్థిరత్వమున్న 222Rn ఐసోటోపు అనునది, 226Ra,238U ఐసోటోపుల క్షయికరణ వలన ఏర్పడుతుంది[4]. 222Rn ఐసోటోపు యొక్క అర్దజీవిత కాలం 3.8రోజులు[8] అత్యంత అస్థిరత్వం కలిగిన 218Rn ఐసోటోపు 222Rn నుండి జనిస్తుంది.211Rn, 210Rn,224Rn ల అర్ధజీవిత కాలం ఒక గంటకు మించి లేదు. ఎక్కువ స్థిరత్వము కలిగిన థోరియం ఐసోటోపు 232Th యొక్క స్వాభావిక క్షయికరణ చేత 220Rnఏర్పడుతుంది.అందుచే ఈ ఐసోటోపును థోరోను అనికూడా అంటారు..దీని యొక్క అర్ధ జీవిత కాలం 55.6 సెకండులు, ఇది అల్పా కణధార్మికత విడుదల చేయును.అలాగే 219Rn అనూఇసోటోపు మిక్కిలి స్థిరమైన అక్టినీయం ఐసోటోపు 227Ac క్షయికరణ వలన ఏర్పడుచున్నది.దీని అర్ధజీవిత వ్యవధి 3.96 సెకండ్లు మాత్రమే.నెప్యూటినియం క్షయికరణ వలన ఎటువంటి రేడాన్ ఐసోటోపులు ఏర్పడినట్లు ఇంతవరకు గుర్తించబడలేదు .
ఐసోటోపు సంతతులు(Progenies)
222Rnఐసోటోపు అనునది రేడియం, యురేనియం-238 గొలుసు కట్టు క్షయికరణ (decay chain) శ్రేణికికు చెందినది.దీని మొదటి నాలుగు క్షయికరన ఉత్పత్తులు అత్యంత క్షణికమైనవి (short-lived).
222Rn ఐసోటోపు యొక్క క్షయికరణ పరివర్తన ఈ దిగువ సూచించిన క్రమంలో జరుగును.
- 222Rn, అర్ద జీవిత కాలం 3.8 రోజులు ఆల్ఫా క్షయికరణ .→ 218Po
- 218Po, అర్ద జీవిత కాలం 3.10 నిమిషాలు ఆల్ఫా క్షయికరణ→ 214Pb
- 214Pb, అర్ద జీవిత కాలం 26.8 నిమిషాలు బీటా క్షయికరణ→ 214Bi
- 214Bi, అర్ద జీవిత కాలం 19.9 నిమిషాలు, బీటా క్షయికరణ→ 214Po
- 210Pb, ఎక్కువ దీర్ఘ అర్ద జీవిత కాలం 22.3 ఏళ్ళు కలది., బీటా క్షయికరణ→ 210Bi
- 210Bi, అర్ద జీవిత కాలం 5.013 రోజులు, బీటా క్షయికరణ→ 210Po
- 210Po, అర్ద జీవిత కాలం 138.376 రోజులు ఆల్ఫా క్షయికరణ→ 206Pb,
- 206Pb, స్థిర స్థితి.

