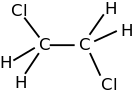
1,2-Дихлорэтан
1,2-Дихло́рэта́н (преж. хлористый этилен) — хлорорганическое вещество; бесцветная жидкость со сладковатым запахом, имеющая формулу ClCH2−СН2Cl[3]. Впервые синтезирован в 1795 году голландскими химиками, из-за чего получил своё название «жидкость голландских химиков»[4]. Широко применяется как полупродукт органического синтеза (наиболее часто — в производстве винилхлорида), а также в качестве растворителя. Токсичен, сильное наркотическое средство, канцероген.
| 1,2-Дихлорэтан | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование | 1,2-дихлорэтан | ||
| Хим. формула | C2H4Cl2 | ||
| Рац. формула | ClCH2CH2Cl | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 98,96 г/моль | ||
| Плотность | 1,254 (при 20 °C) | ||
| Энергия ионизации | 11,05 ± 0,01 эВ[1] и 11,04 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −35,36 °C | ||
| • кипения | 83,47 °C | ||
| • вспышки | 56 ± 1 ℉[1] | ||
| Пределы взрываемости | 6,2 ± 0,1 об.%[1] | ||
| Энтальпия | |||
| • образования | −166,8 кДж/моль | ||
| Удельная теплота испарения | 32,024 Дж/кг | ||
| Удельная теплота плавления | 8,837 Дж/кг | ||
| Давление пара | 64 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,87 г/100 мл | ||
| • в этаноле | растворим | ||
| • в ацетоне | растворим | ||
| • в бензоле | растворим | ||
| • в CCl4 | растворим | ||
| Структура | |||
| Дипольный момент | 1,80 Д | ||
| Классификация | |||
| Рег. номер CAS | 107-06-2 | ||
| PubChem | 11 | ||
| Рег. номер EINECS | 203-458-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI0525000 | ||
| ChEBI | 27789 | ||
| ChemSpider | 13837650 | ||
| Безопасность | |||
| Токсичность | токсично | ||
| Фразы риска (R) | R10, R16, R18, R33, R36/37/38, R39/26/28, R44, R45, R46, R48/21, R51/53, R55, R56, R57, R67 | ||
| Фразы безопасности (S) | S53, S45 | ||
| Пиктограммы СГС | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
История создания
В 1781 году голландские химики Дейманн[нем.] и ван Троствик[нем.] впервые в чистом виде синтезировали этилен (сырьё для получения 1,2-дихлорэтана) воздействием серной кислоты на этанол при нагревании. В 1795 году другие голландские химики Бонд[нем.] и Ловеренбург изучили состав газа, в результате чего он был признан углеводородом. Затем эти же четверо голландских учёных впервые провели реакцию соединения этилена с хлором, продуктом которой стало маслянистое вещество, названное «маслом голландских химиков» (по современной номенклатуре — 1,2-дихлорэтан). Отсюда пошло название «маслородного газа» для этилена[5] и название «олефины» (от лат. oleum — масло) для класса непредельных углеводородов[6].
Физические свойства
1,2-Дихлорэтан представляет собой бесцветную летучую жидкость со сладковатым запахом, напоминающим хлороформ. Хорошо растворяется в спирте, эфире, нефтяных углеводородах, плохо растворим в воде. Плотность при 20 °C составляет 1,253 г/см3. Температура кипения составляет 83,47 °C, а плавления — −35,36 °C. Легко испаряется, образует азеотропную смесь с водой (71,6 °C, 91,8 масс. % дихлорэтана)[7]. Является хорошим растворителем многих органических соединений и полимеров, при этом твердые углеводороды при температуре ниже 25 °C растворяются в дихлорэтане плохо, на этом основано его применение для депарафинизации масел[8].
Химические свойства
1,2-Дихлорэтан вступает в реакции галогенирования, например, взаимодействует с хлором в жидкой или газовой фазе в присутствии радикальных инициаторов, образуя 1,1,2-трихлорэтан[7]:
Подвергается дегидрохлорированию под действием спиртовых или водных растворов щелочей или при нагревании выше 250 °C с образованием винилхлорида[7]:
Вступает в реакцию гидролиза с образованием этиленгликоля. Реакция протекает в присутствии кислот или щелочей при 140—250 °C и давлении до 4 МПа[7]:
При нагревании до 120 °C дихлорэтана с аммиаком в водных или спиртовых средах в присутствии солей аммония получают этилендиамин[7]:
С цианистым натрием дихлорэтан образует сукциннитрил[7]:
Вступает в реакцию алкилирования в присутствии катализаторов Фриделя-Крафтса, взаимодействуя с бензолом и его аналогами[7]:
При нагревании с растворами полисульфидов натрия дихлорэтан образует каучукоподобное вещество тиокол[7]:
Получение
В США, Западной Европе и Японии суммарно производится более 17,5 млн тонн в год 1,2-дихлорэтана[9].
Основным методом получения является катализируемая хлоридом железа (III) реакция присоединения хлора к этилену. Данная реакция протекает в две стадии при температуре 20—80 °С в среде дихлорэтана. На выходе получают продукт чистотой 99,86 % (масс.), селективность процесса повышают до 98,5 % и выше добавками ингибитора[10].
В 1979 году был предложен другой способ проведения данной реакции, заключающийся в том, что хлорирование этилена ведут при температуре 95—130 °С под небольшим давлением в присутствии хлоридов меди и сурьмы в качестве катализаторов, применяя 1—10 % избыток этилена[10].
Другим распространённым способом получения 1,2-дихлорэтана является окислительное хлорирование этилена в присутствии катализатора на основе хлорида меди (II). Степень конверсии этилена составляет 20—40 %[10].
Применение
Наиболее широко 1,2-дихлорэтан применяют в качестве полупродукта для получения винилхлорида (реакция описана выше), а также этиленгликоля, тиокола и других веществ[6].
Как растворитель 1,2-дихлорэтан обладает многими преимуществами, такими как дешевизна, большая растворяющая способность, слабая относительно многих других растворителей воспламеняемость и лёгкость крупнотоннажного получения. Однако ввиду склонности к гидролизу при кипячении с водой с образованием агрессивной солянокислой среды, чаще применяют более дорогой трихлорэтилен[6]. Также хлористый этилен не растворяет нитро- и ацетилцеллюлозу (только в смеси с метанолом или этанолом). Другой причиной, ограничивающей широкое применения дихлорэтана, является его токсичность[11].
1,2-Дихлорэтан применяют в качестве экстрагирующего агента в производстве растительных масел, средства для химчистки и окуривания, а также одного из растворителей при получении лаков[11]. Иногда применяется в сельском хозяйстве для обеззараживания помещения или зерна от насекомых и возбудителей грибковых заболеваний[12].
Зачастую применяется как клей для склеивания изделий из оргстекла и поликарбоната и приготовления жидких клеевых составов на их основе.
Применяется для повышения активности катализатора риформинга бензинов[13].
Безопасность
1,2-Дихлорэтан — сильное наркотическое средство, канцероген[14]. Токсичен, вызывает дистрофические изменения в печени, почках и других органах, может вызвать помутнение роговицы глаз[15]. В организм может попадать при вдыхании и через кожу[16], при работе с веществом необходимо использовать фильтрующий противогаз, а также перчатки. При приёме внутрь или вдыхании паров вызывает отравление, характеризующееся слабостью, головокружением, сонливостью, головными болями, сладким вкусом во рту, тошноту, рвоту, раздражение слизистых оболочек, покраснение кожи, при сильных отравлениях возможны потеря сознания, судороги и летальный исход. Первая помощь пострадавшему — вдыхание свежего воздуха, ингаляция кислородом, искусственное дыхание[8]; подкожное введение камфоры, кофеина, кордиамина[17]. Смертельная доза для человека при приёме внутрь может составлять 10 мл[18].
Допустимая концентрация паров в воздухе рабочей зоны равна 10 мг/м3 (среднесменная за 8 часов) и 30 мг/м3 (максимально разовая)[19]. Порог восприятия запаха может достигать 450—750 мг/м3[20] и 1500 мг/м3[21][нет в источнике].
Максимальная из разовых массовых концентраций примеси в атмосферном воздухе — 3 мг/м3, среднесуточная массовая концентрация примеси — 1 мг/м3. ПДК в воде водоёмов — 2 мг/дм3. Относится к легковоспламеняющимся жидкостям, область воспламенения паров в воздухе составляет 6,2—16 об. %[15].
Примечания
Литература
- Химическая энциклопедия / под ред. И. Л. Кнунянца — М.: Советская энциклопедия, 1990. — Т. 2 : Даф-Мед. — 671 с. — ISBN 5-82270-035-5
- Дебу К. Этилен хлористый // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1891. — Т. IIa. — С. 912—913.