Полиаденили́рование — это процесс присоединения большого количества остатков аденозинмонофосфата (поли(А)-хвоста) к 3'-концу первичной мРНК (пре-мРНК). Иными словами, поли(А)-хвост — это фрагмент молекулы мРНК, азотистые основания которого представлены только аденином. У эукариот полиаденилирование является частью процессинга мРНК — процесса созревания первичного транскрипта в зрелую мРНК, готовую для трансляции. Процессинг, в свою очередь, является одним из этапов экспрессии генов.

Полиаденилирование начинается, когда завершается транскрипция гена, то есть образование первичного транскрипта. Перед началом полиаденилирования особый мультисубъединичный белковый комплекс отщепляет 3'-концевой участок первичного транскрипта. Место расщепления определяется положением универсальных сигнальных последовательностей в первичном транскрипте; в некоторых случаях расщепление может происходить в нескольких альтернативных сайтах. Таким образом, полиаденилирование даёт возможность для образования различных мРНК одного гена (альтернативное полиаденилирование), подобно тому, как это происходит при альтернативном сплайсинге. После формирования нового 3'-конца транскрипта компонент белкового комплекса поли(А)-полимераза осуществляет синтез поли(А)-хвоста, используя 3'-концевой нуклеотид как затравку[1].
Поли(А)-хвост играет важную роль в транспорте мРНК из ядра, её трансляции и стабильности. Со временем поли(А)-хвост укорачивается, и, когда его длина станет достаточно малой, мРНК разрушается под действием специальных ферментов[2]. Однако в клетках некоторых типов мРНК с короткими поли(А)-хвостами запасаются в цитозоле для дальнейшей активации путём реполиаденилирования[3]. У бактерий, напротив, полиаденилирование запускает разрушение транскрипта[4]. Подобный эффект полиаденилирования отмечен и для некоторых эукариотических некодирующих РНК[5].
Ядерное полиаденилирование
Функции
При ядерном полиаденилировании поли(А)-хвост присоединяется к мРНК в конце транскрипции. Полиаденилирование защищает мРНК от ферментативного разрушения в цитоплазме, способствует терминации транскрипции, участвует в экспорте мРНК из ядра и трансляции[2]. Практически все эукариотические мРНК полиаденилируются[6], исключением являются мРНК гистонов, образование которых зависит от циклов репликации исходной ДНК[7]. Они являются единственными эукариотическими мРНК, у которых отсутствует поли(А)-хвост, вместо него на 3'-конце транскрипта располагается шпилька, за которой находится обогащённая пуринами последовательность (гистоновый нисходящий элемент (англ. histone downstream element)), отмечающая место, где был произведён разрез исходного транскрипта[8].
Многие эукариотические некодирующие РНК также полиаденилируются в конце трансляции. Среди них есть малые РНК, у которых поли(А)-хвост имеется лишь на промежуточной стадии, но удаляется в ходе процессинга и отсутствует у зрелых молекул (таковы, например, микроРНК)[9][10]. Однако у многих длинных некодирующих РНК, по-видимому, являющихся обширной группой регуляторных РНК (например, у РНК Xist, задействованной в инактивации Х-хромосомы), поли(А)-хвост является частью зрелой РНК[11].
Механизм
| Задействованные белки:[6] CPSF[англ.]: фактор специфичности разрезания и полиаденилирования РНК |
В ядре аппарат полиаденилирования работает с продуктами активности РНК-полимеразы II, например, предшественниками мРНК[англ.]. При этом мультибелковый комплекс (см. справа) отрезает наиболее близкую к 3'-концу часть транскрипта и полиаденилирует образовавшийся в результате разреза конец. Этот разрез катализируется ферментом CPSF[англ.][7] и происходит на 10—30 нуклеотидов ниже его сайта связывания[12]. Обычно сайтом связывания CPSF служит последовательность AAUAAA, однако возможны и другие последовательности, с которыми CPSF связывается более слабо[13]. Специфичность связывания с РНК обеспечивается двумя другими белками: CstF и CFI. CstF связывается с GU-богатым участком РНК ниже сайта связывания CPSF[14]. CFI связывается со специальным сайтом на РНК (у млекопитающих это набор последовательностей UGUAA[15][16][17]) и может обеспечить связывание CPSF с транскриптом даже в отсутствие сигнала AAUAAA[18][19]. Сигнал полиаденилирования — особая последовательность, распознаваемая белковым комплексом, разрезающим РНК — варьирует у различных групп эукариот. У человека сигналом полиаденилирования в большинстве случаев служит последовательность AAUAAA[14], но у растений и грибов она является сигналом полиаденилирования реже[20].
Обычно разрезание РНК происходит до завершения транскрипции, поскольку CstF также связывается с РНК-полимеразой II[21]. CstF служит сигналом к диссоциации от цепи для РНК-полимеразы II, однако механизм этого сигнала плохо понятен[22]. В разрезании также принимает участие белок CFII, однако его роль ещё не ясна[23]. Сайт разрезания связан с сигналом полиаденилирования, и его длина может составлять до 50 нуклеотидов[24].
После разрезания РНК начинается полиаденилирование, катализируемое ферментом полиаденилат-полимеразой[англ.] (поли(А)-полимеразой). Поли(А)-полимераза осуществляет наращивание поли(А)-хвоста, добавляя к РНК АМФ, получаемый из АТФ с высвобождением пирофосфата[25]. Другой белок — PAB2 — связывается с новым, ещё коротким поли(А)-хвостом и увеличивает сродство поли(А)-полимеразы к РНК. Когда длина поли(А)-хвоста достигает приблизительно 250 нуклеотидов, поли(А)-полимераза более не может быть связанной с CPSF и полиаденилирование останавливается, тем самым детерминируя длину поли(А)-хвоста[26][27]. Поскольку CPSF также связан с РНК-полимеразой II, он посылает ей сигнал о прекращении транскрипции[28][29]. Когда РНК-полимераза II достигает терминирующей последовательности (ТТАТТ на ДНК-матрице и AAUAAA на первичном транскрипте), происходит терминация транскрипции[30]. Аппарат полиаденилирования также физически связан со сплайсосомой — комплексом, вырезающим интроны из РНК[19].
Последующие эффекты

Поли(А)-хвост выступает сайтом связывания для поли(А)-связывающего белка[англ.] (PABP). PABP способствует экспорту РНК из ядра и трансляции, в то же время подавляя её деградацию[31]. Связывание этого белка с поли(А)-хвостом происходит до экспорта РНК из ядра. У дрожжей PABP привлекает к транскрипту поли(А)-нуклеазу — фермент, укорачивающий поли(А)-хвост и тем самым делающий возможным транспорт РНК из ядра. Вместе с РНК в цитоплазму перемещается и РАВР. мРНК, не экспортированные в цитоплазму, разрушаются специальным комплексом — экзосомой[32][33]. РАВР также способен связываться и привлекать к транскрипту ряд белков, оказывающих влияние на трансляцию[32], например, фактор инициации[англ.] 4G, который, в свою очередь, участвует в привлечении к мРНК рибосомной субъединицы 40S[34]. Кроме того, PABP за счёт связывания с факторами инициации трансляции, связанными с 5'-концом мРНК, обеспечивает образование замкнутой петли из линейной мРНК (циркуляризацию мРНК). По-видимому, циркуляризация мРНК обеспечивает эффективную «круговую» трансляцию, при которой за счёт сближенности 5'- и 3'-концов рибосома, подошедшая к 3'-концу мРНК, не диссоциирует от неё, а сразу переходит на 5'-конец и начинает новый раунд трансляции[35]. Наконец, кроме общих механизмов воздействия PABP на трансляцию, они могут специфически влиять на трансляцию отдельных мРНК[36]. Тем не менее, поли(А)-хвост не является необходимым для трансляции всех мРНК[37].
Деаденилирование
В соматических клетках эукариот поли(А)-хвост в цитоплазме укорачивается, и мРНК с укороченными поли(А)-хвостами меньше транслируются и быстрее деградируются[38]. Однако до полной деградации мРНК может пройти несколько часов[39]. Это деаденилирование и деградация мРНК могут ускоряться микроРНК, связывающимися с 3'-нетранслируемой областью (3'-UTR) транскрипта[40]. В ооцитах мРНК с укороченными поли(А)-хвостами не разрушаются, а запасаются в неактивном виде без трансляции и впоследствии активируются путём цитоплазматического полиаденилирования, происходящего после оплодотворения в ходе активации яйца[англ.][41]. Это явление получило название «маскирование мРНК»[42].
У животных поли(А)-рибонуклеаза[англ.] может связываться с кэпом и при этом удалять нуклеотиды с поли(А)-хвоста. Доступность связывания с кэпом и поли(А)-хвостом важна для регуляции того, как скоро мРНК будет разрушена. PARN имеет меньшую деаденилирующую активность, если с РНК связаны факторы инициации трансляции 4E в области кэпа и 4G на поли(А)-хвосте, поэтому трансляция сокращает деаденилирование. Скорость деаденилирования может также регулироваться РНК-связывающими белками[англ.]. После удаления с транскрипта поли(А)-хвоста декэпирующий комплекс убирает кэп, что ведёт к деградации РНК. У дрожжей также было идентифицировано несколько других ферментов, задействованных в деаденилировании[43].
Альтернативное полиаденилирование
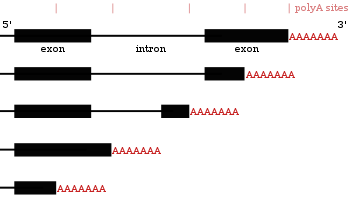
Многие белоккодирующие гены могут иметь более одного сайта полиаденилирования, поэтому с одного и того же гена можно получить несколько РНК, различающихся своими 3'-концами[20][44][45]. Это явление получило название альтернативного полиаденилирования. Поскольку альтернативное полиаденилирование изменяет длину 3'-UTR, оно может повлиять на то, какие сайты связывания с микроРНК останутся на транскрипте[12][46]. Обычно микроРНК подавляют трансляцию и запускают деградацию мРНК, с которыми они связаны, хотя известны примеры, когда микроРНК стабилизирует транскрипт[47][48]. Альтернативное полиаденилирование может также изменить длину кодирующей области, из-за чего получающиеся мРНК будут кодировать различные белки[49][50], однако такое явление встречается реже, чем укорочение 3'-UTR[20].
Выбор сайта полиаденилирования может зависеть от внеклеточных стимулов и экспрессии определённых белков, участвующих в полиаденилировании[51][52]. Например, экспрессия белка CSTF2[англ.] — субъединицы CstF — активирует макрофаги в ответ на липополисахариды (группа бактериальных соединений, вызывающих иммунный ответ). Это приводит к выбору более слабого сайта полиаденилирования и образованию более коротких транскриптов с укороченной 3'-UTR у генов, белковые продукты которых участвуют в осуществлении защитной реакции (например, лизоцима и TNF-α). В результате в этих транскриптах отсутствуют некоторые регуляторные элементы, локализующиеся в 3'-UTR, что увеличивает их срок жизни и даёт возможность для образования большего количества защитных белков[51]. Роль в выборе сайта полиаденилирования могут играть и белки, не связанные непосредственно с аппаратом полиаденилирования[52][53][54][55], например, усиливающие метилирование ДНК рядом с сайтом полиаденилирования[56].
Цитоплазматическое полиаденилирование
В некоторых клетках животных, а именно клетках зародышевой линии в ходе раннего эмбриогенеза, а также постсинаптических участках нейронов происходит полиаденилирование в цитозоле. В ходе цитоплазматического полиаденилирования происходит удлинение поли(А)-хвоста у инактивированных мРНК с укороченным поли(А)-хвостом. В результате цитоплазматического полиаденилирования они активируются и транслируются[38][57]. До этого длина поли(А)-хвоста таких мРНК составляет около 20 нуклеотидов, а в ходе цитоплазматического полиаденилирования он удлиняется до 80—150 нуклеотидов[3].
В раннем эмбрионе мыши цитоплазматическое полиаденилирование инактивированных материнских мРНК, содержавшихся в яйцеклетке до оплодотворения, позволяет клеткам выжить и расти, хотя транскрипция в самом зародыше начинается на двуклеточной (у человека — четырёхклеточной) стадии[58][59]. В мозге цитоплазматическое полиаденилирование активируется в процессе обучения и может играть роль в долговременной потенциации[3][60].
В цитоплазматическом полиаденилировании задействованы РНК-связывающие белки CPSF и CPEB, кроме того, в нём могут и участвовать другие РНК-связывающие белки, например, PUM1[англ.][61]. В зависимости от типа клеток цитоплазматическое полиаденилирование может осуществлять либо поли(А)-полимераза, идентичная той, что задействована в ядерном полиаденилировании, либо цитоплазматическая полимераза GLD-2[62].
Роль в деградации РНК у эукариот
Для многих некодирующих РНК, в том числе тРНК, рРНК, малых ядерных РНК и малых ядрышковых РНК полиаденилирование является меткой для их деградации, по крайней мере, у дрожжей[63]. Полиаденилирование таких РНК осуществляет комплекс TRAMP, присоединяющий около 4 нуклеотидов к их 3'-концу[64]. Меченная таким образом РНК разрушается экзосомой[65]. У человеческих рРНК также были выявлены поли(А)-хвосты, причём среди них были как гомополимерные (состоящие только из А), так и гетерополимерные (состоящие по большей части из А) хвосты[66].
Полиаденилирование у прокариот и органелл

У многих бактерий полиаденилируются как мРНК, так и некодирующие РНК. Поли(А)-хвосты в этом случае стимулируют деградацию этих РНК специальным мультибелковым комплексом — деградосомой, который включает два РНК-разрушающих фермента: полинуклеотидфосфорилазу[англ.] и РНКазу E[англ.]. Полинуклеотидфосфорилаза связывается с 3'-концом РНК, а поли(А)-хвост за счёт дополнительного места для посадки фермента даёт возможность этому ферменту связаться с РНК, чья вторичная структура делала невозможной посадку на непосредственно 3'-конец. Последующие циклы полиаденилирования и деградации 3'-конца, осуществляемые полинуклеотидфосфорилазой, позволяют деградосоме преодолевать неудобную вторичную структуру транскрипта. Поли(А)-хвост может также привлекать РНКазы, разрезающие РНК на два фрагмента[67]. Такие бактериальные поли(А)-хвосты имеют длину около 30 нуклеотидов[68].
У трипаносом в митохондриях открыты примеры полиаденилирования, как стабилизирующие, так и дестабилизирующие РНК. Дестабилизирующие поли(А)-хвосты известны и для мРНК, и для некодирующих РНК. Средняя длина поли(А)-хвостов в митохондриях трипаносом составляет около 43 нуклеотидов. Стабилизирующие поли(А)-хвосты начинаются со стоп-кодона, и без поли(А)-хвоста в мРНК нет стоп-кодона UAA, потому что в мРНК без поли(А)-хвоста встречаются U и сочетание UA, но не UAA. Для митохондрий растений известно только дестабилизирующее полиаденилирование, а в митохондриях дрожжей полиаденилирования вообще нет[69].
Хотя у бактерий и митохондрий имеется поли(А)-полимераза, у них встречается и другой тип полиаденилирования, осуществляемый полинуклеотидфосфорилазой самой по себе. Этот фермент имеется у бактерий[70], митохондрий[71], пластид[72], а также входит в состав экзосом архей[73]. Он способен синтезировать продолжение 3'-конца, и в этом продолжении подавляющее число азотистых оснований представлено аденином. Как и у бактерий, полиаденилирование, осуществляемое полинуклеотидфосфорилазой, стимулирует разрушение РНК у пластид[74] и, возможно, архей[69].
Эволюция
Хотя полиаденилирование имеется у практически всех организмов, его механизмы не универсальны[75][76]. Однако широкое распространение полиаденилирования и факт того, что оно имеется у организмов из всех трёх доменов жизни, даёт основания предполагать, что последний универсальный общий предок всех организмов в некотором виде имел систему полиаденилирования[68]. Небольшое число организмов не полиаденилируют свои мРНК, что свидетельствует о том, что они утратили способность к полиаденилированию в ходе эволюции. Хотя примеры эукариот, лишённых полиаденилирования, неизвестны, у бактерии Mycoplasma gallisepticum[англ.] и галофильной археи Haloferax volcanii эта модификация отсутствует[77][78].
Наиболее древним полиаденилирующим ферментом является полинуклеотидфосфорилаза. Этот фермент входит в состав бактериальных деградосом и экзосом архей[79] — двух близкородственных комплексов, расщепляющих РНК на нуклеотиды. Этот фермент разрушает РНК, атакуя по фосфату связь между двумя самыми ближними к 3'-концу нуклеотидами, отрывая от РНК дифосфатный нуклеотид. Эта реакция обратима, поэтому этот фермент может и удлинить 3'-конец. Гетерополимерный хвост, добавляемый полинуклеотидфосфорилазой, чрезвычайно насыщен аденином. Выбор из всех азотистых оснований именно аденина для этих целей обусловлен, по-видимому, большей, по сравнению с другими нуклеотидами, концентрацией АДФ, потому что АДФ образуется при расщеплении АТФ для получения энергии; по-видимому, именно это и стало причиной образования поли(А)-хвоста у ранних форм жизни. Предполагается, что участие поли(А)-хвостов в деградации РНК послужило толчком для дальнейшей эволюции поли(А)-полимераз, которые обеспечивают присоединение поли(А)-хвоста, все азотистые основания которого представлены аденином[80].
Поли(А)-полимеразы не являются такими древними ферментами, как полинуклеотидфосфорилаза. У бактерий и эукариот они появились независимо от САА-добавляющего фермента[англ.] — фермента, осуществляющего созревание 3'-концов тРНК. Его каталитический домен не гомологичен таковому у других полимераз[65]. Предполагается, что горизонтальный перенос бактериального САА-добавляющего фермента к эукариотам позволил архееподобному САА-добавляющему ферменту сменить функцию на поли(А)-полимеразную[68]. У некоторых групп организмов, например, архей и цианобактерий, в ходе эволюции поли(А)-полимераза никогда не появлялась[80].
История изучения
Впервые полиаденилирование было идентифицировано в 1960-х как ферментативная активность в экстрактах клеточных ядер, полимеризовавшая АДФ, но не АТФ, в полиаденин[81][82]. Хотя впоследствии такая ферментативная активность была обнаружена в клетках многих типов, её функции были неизвестны до 1971 года, когда поли(А)-последовательности были выявлены в мРНК[83][84]. Первоначально единственной функцией этих последовательностей считали защиту мРНК от действия нуклеаз, в дальнейшем были установлены роли полиаденилирования в транспорте мРНК из ядра и трансляции. Полимеразы, осуществляющие полиаденилирование, были выделены и охарактеризованы в 1960-х и 1970-х, но большое число дополнительных белков, участвующих в этом процессе, было открыто лишь в начале 1990-х[83].
Примечания
Литература
- Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка. — М.: Издательский центр «Академия», 2011. — 496 с. — ISBN 978-5-7695-6668-4.
- Lucy W. Barrett, Sue Fletcher, Steve D. Wilton. Untranslated Gene Regions and Other Non-coding Elements. — SpringerBriefs in Biochemistry and Molecular Biology, 2013. — 57 p. — ISBN 978-3-0348-0679-4.
- Elkon R., Ugalde A. P., Agami R. Alternative cleavage and polyadenylation: extent, regulation and function. (англ.) // Nature reviews. Genetics. — 2013. — Vol. 14, no. 7. — P. 496—506. — doi:10.1038/nrg3482. — PMID 23774734.
Ссылки
- Старокадомский, Пётр. мРНКаааауу. // Сайт Biomolecula.ru (30 июня 2009). Дата обращения: 26 марта 2018. Архивировано 18 марта 2018 года.