Ви́рус иммунодефици́та челове́ка (ВИЧ) — ретровирус из рода лентивирусов, вызывающий медленно прогрессирующее[3] заболевание — ВИЧ-инфекцию[4][5].
| Вирус иммунодефицита человека | |
|---|---|
![Стилизованное изображение сечения ВИЧ[1]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ea/Human_Immunodeficency_Virus_-_stylized_rendering.jpg/275px-Human_Immunodeficency_Virus_-_stylized_rendering.jpg) Стилизованное изображение сечения ВИЧ[1] | |
| Научная классификация | |
Реалм: Царство: Pararnavirae Тип: Artverviricota Класс: Порядок: Семейство: Подсемейство: Orthoretrovirinae Род: Группа: Primate lentivirus group | |
| Международное научное название | |
| Primate lentivirus group | |
| Виды | |
| |
| Группа по Балтимору | |
| VI: оцРНК-ОТ-вирусы | |
Вирус поражает клетки иммунной системы, имеющие на своей поверхности рецепторы CD4: Т-хелперы, моноциты, макрофаги, клетки Лангерганса[6], дендритные клетки, клетки микроглии[7]. В результате работа иммунной системы угнетается и развивается синдром приобретённого иммунного дефицита (СПИД), организм больного теряет возможность защищаться от инфекций и опухолей, возникают вторичные оппортунистические заболевания, которые не характерны для людей с нормальным иммунным статусом[8][9][10][11][12][13].
Лечение ВИЧ-инфекции заключается в приёме антиретровирусной терапии, которая позволяет ВИЧ-положительным людям вести нормальный образ жизни, а её качество и продолжительность может не отличаться при должной терапии от таковых у ВИЧ-отрицательных людей[14][15]. При приёме указанной терапии человек достигает неопределяемой вирусной нагрузки, вследствие чего не способен передать инфекцию другим людям, в том числе при незащищённом половом акте[16][17][18][19], также терапия позволяет ВИЧ-положительным родителям естественным путём зачать и родить здорового ребёнка[20]. В отсутствие приёма терапии прогрессирующая ВИЧ-инфекция способна привести к оппортунистическим заболеваниям.
Открытие ВИЧ


В 1981 году появились первые три научные статьи о необычных случаях развития пневмоцистной пневмонии и саркомы Капоши у гомосексуальных мужчин[23][24]. До этого оба заболевания встречались редко и были характерны для совершенно разных групп пациентов: саркомой Капоши в основном болели пожилые мужчины средиземноморского происхождения, а пневмоцистной пневмонией — пациенты с лейкозом после интенсивной химиотерапии. Появление этих заболеваний, свидетельствующих о тяжёлом иммунодефицитном состоянии, у молодых людей, не входящих в соответствующие группы риска, наблюдалось впервые[24]. Затем обнаружили такие же симптомы среди наркопотребителей, больных гемофилией A[25], и гаитян[26][27]. Наиболее значимым было обнаружение снижения соотношения CD4+/CD8+-клеток в результате относительного и/или абсолютного уменьшения количества CD4+-лимфоцитов в сочетании с увеличением количества CD8+-лимфоцитов[24][28][29].
В июле 1982 года для обозначения этого состояния был предложен термин синдром приобретённого иммунного дефицита (СПИД, AIDS)[30]. В сентябре 1982 года СПИДу было дано полноценное определение как нозологической форме на основании наблюдения ряда оппортунистических инфекций у четырёх групп пациентов, указанных выше[24][31].
В период с 1981 по 1984 год вышло несколько работ, связывающих вероятность развития СПИДа с анальным сексом или с влиянием наркотиков[32][33][34][35][36][37]. Параллельно велись работы над гипотезой о возможной инфекционной природе СПИДа.
Вирус иммунодефицита человека был открыт в 1983 году в двух лабораториях, работавших независимо друг от друга: в Институте Пастера во Франции под руководством Люка Монтанье и в Национальном институте рака в США под руководством Роберта Галло. Результаты исследований, в которых из тканей пациентов с симптомами СПИДа впервые удалось выделить новый ретровирус, были опубликованы 20 мая 1983 года в журнале Science[38][39]. В этих же работах выделенный из больных СПИДом вирус был впервые успешно размножен в культивируемых Т-лимфоцитах. Французская группа исследователей показала, что серологически этот вирус отличается от HTLV-I, и назвала его LAV («вирус, ассоциированный с лимфаденопатией»), а американская группа назвала его HTLV-III, ошибочно отнеся к группе HTLV-вирусов. Исследователи выдвинули предположение, что вирус может вызывать синдром приобретённого иммунного дефицита[24].
В 1986 году было доказано, что вирусы, открытые в 1983 французскими и американскими исследователями, генетически идентичны. Первоначальные названия вирусов были упразднены и предложено одно общее название — вирус иммунодефицита человека[40]. В 2008 году Люк Монтанье и Франсуаза Барр-Синусси были удостоены Нобелевской премии в области физиологии или медицины «за открытие вируса иммунодефицита человека»[41].
ВИЧ-инфекция
Инфицирование
Вирус может передаваться через прямой контакт повреждённой или неповреждённой слизистой оболочки или повреждённой кожи здорового человека с биологическими жидкостями заражённого человека: кровью, предсеменной жидкостью (выделяющейся на протяжении всего полового акта), спермой, секретом влагалища, грудным молоком. Передача вируса может происходить при незащищённом анальном, вагинальном или оральном сексе[42][43].
Интактная, неповреждённая кожа является эффективным барьером для инфекции, так как в коже отсутствуют клетки, которые могут быть заражены ВИЧ. Для успешной инфекции требуется прямой контакт с кровеносной системой или с мембранами клеток слизистых оболочек. Слизистые оболочки половых органов и прямой кишки часто получают незначительные повреждения при половом акте, через которые вирус может проникать в кровь. Такие повреждения чаще возникают при наличии заболеваний, передающихся половым путём, например, в случае герпеса. Поэтому особенно опасной формой полового акта для принимающего партнёра является незащищённый анальный секс, так как при этой форме возникает наибольшее число мелких и крупных повреждений[44][45]. С другой стороны, заражение возможно и в случае неповреждённой слизистой оболочки, так как слизистая содержит значительное количество дендритных клеток (в том числе, клеток Лангерганса), которые могут играть роль «переносчиков» вирусных частиц в лимфатические узлы.
Передача вируса происходит с большей вероятностью при использовании заражённых игл и шприцев (особенно потребителями инъекционных наркотиков), а также при переливании крови (в случае нарушения медицинским персоналом установленных процедур проверки донорской крови)[46]. Также передача вируса может произойти между матерью и ребёнком во время беременности, родов (заражение через кровь матери)[47][48] и при грудном вскармливании (причём как от заражённой матери к здоровому ребёнку через грудное молоко, так и от заражённого ребёнка к здоровой матери через покусывание груди во время кормления)[49].
Вирус не передаётся воздушно-капельным путём, бытовым путём, при соприкосновении с неповреждённой кожей, через укусы большинства кровососущих насекомых[50] (исключение составляют мухи-жигалки)[нет в источнике (обс.)], слёзы[51] и слюну (из-за того, что концентрация вирионов ВИЧ в этих жидкостях ниже инфицирующей дозы, а также из-за того, что слюна — агрессивная среда, разрушающая своими ферментами вирионы ВИЧ)[51].
Вирус не стоек во внешней среде, быстро погибает под прямыми солнечными лучами; при температуре выше 57⁰C, и практически моментально при 100⁰C; также вирус очень чувствителен к кислотности (он может выжить только при pH от 7 до 8), щелочным и солёным средам[52].
Болезнь
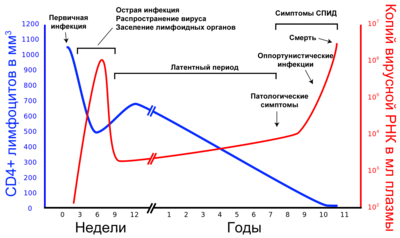
В течение болезни выделяют три стадии: острую инфекцию, латентный период и терминальную стадию (СПИД) (см. иллюстрацию). В ходе развития ВИЧ-инфекции у одного и того же человека в результате мутаций возникают новые штаммы вируса, которые различаются по скорости воспроизведения и способности инфицировать[8][9]. Размножившись, вирусные частицы высвобождаются из поражённых клеток и внедряются в новые — цикл развития повторяется. Инфицированные вирусом Т-хелперы постепенно гибнут из-за разрушения вирусом, апоптоза или уничтожения Т-киллерами. В процессе развития ВИЧ-инфекции количество CD3-CD4 лимфоцитов снижается настолько, что организм уже не может противостоять возбудителям оппортунистических инфекций, которые неопасны или мало опасны для здоровых людей с нормально функционирующей иммунной системой. Причины снижения могут быть различными:
1 — перераспределение пролимфоцитов в сторону CD3-CD8 или естественных киллеров, вызываемое, например, герпесом 4го типа
2 — комплиментарность gp120 и рецептора CD4 — вызывает аутоимунную реакцию, выработку антител, разрушающих CD3-CD4 лимфоцит (наличие данного белка необходимо определять с учётом погрешности тест систем)
3 — сопутствующими заболеваниями, угнетающими костный мозг или органы кроветворения (тимус, лимфатическую систему).
Согласно сведениям об исследованиях данной проблемы, только около 4 % CD3-CD4 лимфоцитов поражается вирусом.
Причем необходимо понимать, что CD3-CD4 и CD3-CD8 лимфоциты это постоянно вырабатываемые организмом клетки из пролимфоцитов, организм сам регулирует какой пролимфоцит станет CD4, CD8 или естественным киллером.
На терминальной стадии (СПИД) ослабленный организм поражают бактериальные, грибковые, вирусные и протозойные инфекции, а также опухоли[11][12][13]. В отсутствие антиретровирусной терапии смерть пациента наступает не в результате размножения вируса в CD4+-клетках, а по причине развития оппортунистических заболеваний (вторичных по отношению к ВИЧ-инфекции).
Эпидемиология
По данным на 2011 год, в мире за всё время ВИЧ-инфекцией заболели 60 миллионов человек, из них: 25 миллионов умерли, а 35 миллионов живут с ВИЧ-инфекцией[54]. Более двух третей из них проживают в Африке к югу от пустыни Сахара[55]. Эпидемия началась здесь в конце 1970-х — начале 1980-х. Затем эпидемия перекинулась в США, Западную Европу и страны Южной Африки. Сегодня, за исключением стран Африки, быстрее всего вирус распространяется в Центральной Азии и Восточной Европе (в том числе в России). Эпидемическая ситуация в этих регионах сдерживалась до конца 1990-х, затем с 1999 по 2002 годы количество инфицированных почти утроилось — в основном за счёт инъекционных наркоманов. Значительно ниже среднего ВИЧ-инфекция распространена в Восточной Азии, Северной Африке и на Ближнем Востоке. В масштабе планеты эпидемическая ситуация стабилизировалась, количество новых случаев ВИЧ-инфекции снизилось с 3,5 миллиона в 1997 году до 2,7 миллиона в 2007 году[55]. По данным на конец 2016 года, в России 848 тысяч человек живут с ВИЧ-инфекцией, за период с 1986 по 2016 год умерло от разных причин 220 тысяч ВИЧ-инфицированных граждан России[56] (подробнее см. Статистика заболеваемости и смертности по России).
Диагностика
Анализ крови позволяет обнаружить антитела к белкам вируса (ИФА), реакцию антител на белки вируса (вестерн-блот), РНК вируса (ОТ-ПЦР)[57]. Определение вирусной нагрузки (подсчёт количества копий РНК вируса в миллилитре плазмы крови) позволяет судить о стадии заболевания и эффективности лечения[58][59].
Обязательная проверка донорской крови в развитых странах в значительной степени сократила возможность передачи вируса при её использовании. Тестирование на ВИЧ беременных женщин позволяет своевременно начать приём лекарств и родить здорового ребёнка.
Существует мнение, что принудительное тестирование населения бесперспективно с точки зрения сдерживания эпидемии[60] и нарушает права человека[61]. В России проведение теста без согласия человека является незаконным[62], однако существуют ситуации, в которых предоставление результатов тестирования на ВИЧ является обязательным, но не насильственным (донорство, трудоустройство медицинских работников, для иностранных граждан, получающих разрешение на пребывание в РФ, в местах лишения свободы при наличии клинических показаний)[63].
Лечение
На 2022 год известно о четырёх случаях излечения от вируса. Три из них в медицинской литературе фигурируют под прозвищами «Берлинский», «Лондонский» и «Сан-Паулский» пациенты, эффект в их случаях был достигнут при помощи пересадки костного мозга (донорские клетки содержали мутацию CCR5-Δ32, делающую их невосприимчивыми к ВИЧ)[64][65][66]. В начале 2022 года стало известно[67] о четвёртом человеке, который излечился от ВИЧ, на этот раз с помощью трансплантации клеток пуповинной крови, содержащих мутацию CCR5-Δ32[67]. В марте 2023 года в журнале Cell вышла статья, описывающая данный случай[68].
Из 35 миллионов человек, живущих с ВИЧ-инфекцией, часть остаётся в живых благодаря антиретровирусной терапии. В случае отсутствия антиретровирусной терапии ВИЧ-инфекции, смерть наступает в среднем через 9—11 лет после заражения[8][10]. При проведении антиретровирусной терапии продолжительность жизни пациента составляет 70—80 лет[69][70][71]. Антиретровирусные препараты мешают ВИЧ размножаться в клетках иммунной системы человека, блокируя внедрение вирионов в клетки и нарушая на разных этапах процесс сборки новых вирионов. Своевременно начатое лечение антиретровирусными препаратами в сотни раз снижает риск развития СПИДа и последующей смерти[72][73][74]. Антиретровирусные препараты у части пациентов вызывают побочные эффекты, в некоторых случаях даже требующие сменить схему лечения (набор принимаемых лекарств).
Терапию назначают при снижении иммунитета и/или высокой вирусной нагрузке. Если число CD4+-лимфоцитов велико и вирусная нагрузка низкая, терапию не назначают. После назначения терапии лекарства нужно принимать ежедневно в одно и то же время и пожизненно, что создаёт неудобства для пациентов. Кроме того, следует учитывать высокую стоимость месячного курса лекарств. В 2014 году необходимые лекарства получали менее половины из 9,5 млн человек, нуждающихся в противовирусной терапии[75].
Также все беременные женщины с ВИЧ-инфекцией должны начинать незамедлительную АРВТ для предотвращения передачи ВИЧ плоду[76].
Согласно рекомендациям ВОЗ, АРВТ следует незамедлительно начинать всем ВИЧ-инфицированным детям до полутора лет[77]. Начало терапии у детей, получивших ВИЧ от матери, в течение 3 месяцев после родов снижает смертность на 75 %[78]. В отсутствие лечения треть ВИЧ-инфицированных детей умирает в течение первого года жизни и 50 % — в течение второго года. Если диагностика ВИЧ невозможна, лечение следует начинать в возрасте 9 месяцев, либо ранее, в случае появления симптомов[79].
По состоянию на февраль 2016 года было объявлено, что группе немецких учёных удалось полностью удалить тип ВИЧ-1 из живых клеток. Испытания проводились на клетках человека, вживлённых подопытным мышам. Испытания на людях должны проводиться в ближайшее время[80][81][82].
В 2018 году Администрацией по контролю над продуктами и лекарствами (FDA) был одобрен ибализумаб (ibalizumab-uiyk) для применения в терапии пациентов с мультирезистентным ВИЧ-1. Препарат представляет собой моноклональное антитело, которое связывается с CD4 рецепторами T-клеток и подавляет процесс проникновения вируса в клетку человека. Ибализумаб может применяться в терапии с другими антиретровирусными лекарствами. По результатам клинических исследований с участием 40 пациентов, ранее прошедших лечение более чем 10 различными антиретровирусными агентами, вирусная нагрузка снизилась у большинства испытуемых через одну неделю после введения первой дозы препарата. Через 24 недели терапии вирусологическая супрессия была достигнута у 43 % участников клинических испытаний[83].
ВИЧ в 2019 году вносили в список десяти основных проблем здравоохранения, которые требуют особого внимания ВОЗ[84].
Классификация
Вирус иммунодефицита человека относят к семейству ретровирусов (Retroviridae), роду лентивирусов (Lentivirus). Название Lentivirus происходит от латинского слова lente — медленный. Такое название отражает одну из особенностей вирусов этой группы, а именно — медленную и неодинаковую скорость развития инфекционного процесса в макроорганизме. Для лентивирусов также характерен длительный инкубационный период[85].
Для вируса иммунодефицита человека характерна высокая частота генетических изменений, возникающих в процессе самовоспроизведения. Частота возникновения ошибок у ВИЧ составляет 10−3 — 10−4 ошибок на геном на цикл репликации, что на несколько порядков больше аналогичной величины у эукариот. Размер генома ВИЧ составляет примерно 104 нуклеотидов. Из этого следует, что практически каждый дочерний геном хотя бы на один нуклеотид отличается от своего предшественника. В современной классификации различают два основных вида ВИЧ — ВИЧ-1 и ВИЧ-2. Предполагается, что эти вирусы возникли в результате независимой передачи людям SIV (вируса иммунодефицита обезьян) от шимпанзе и мангабеев соответственно[86].
И ВИЧ-1, и ВИЧ-2 способны вызывать серьёзный иммунодефицит, однако клиническое течение болезни несколько различается. Известно, что ВИЧ-2 менее патогенен и передаётся с меньшей вероятностью, чем ВИЧ-1. Вероятно, это связано с тем, что ВИЧ-2-инфекция характеризуется более низким числом вирусных частиц на миллилитр крови. Отмечено, что инфекция ВИЧ-2 обеспечивает носителю небольшую защиту от заражения ВИЧ-1. Однако описаны случаи двойной инфекции, причём заражение может происходить в любом порядке. Инфекция ВИЧ-2 реже заканчивается развитием СПИДа. Есть сведения о несколько большей частоте развития саркомы Капоши, кандидоза ротовой полости и хронической лихорадки при ВИЧ-1/СПИДе. При ВИЧ-2/СПИДе чаще развивается энцефалит, хроническая или бактериальная диарея, серьёзные цитомегаловирусные инфекции и холангит[86]. К роду Lentivirus также относят виды, вызывающие схожие заболевания у обезьян, кошек, лошадей, овец и т. д.[8][87][88]
ВИЧ-1
ВИЧ-1 описан в 1983 году и является наиболее распространённым и патогенным видом ВИЧ[89]. Глобальная эпидемия ВИЧ-инфекции главным образом обусловлена распространением ВИЧ-1. В подавляющем большинстве случаев, если не оговорено иначе, под ВИЧ подразумевают ВИЧ-1[90].
Вид ВИЧ-1 классифицируют на главную группу М и несколько побочных групп. Считается, что группы M, N, O, P образовались в результате независимых случаев передачи SIV от обезьяны к человеку, и последующей мутации вируса до ВИЧ[91].
- Вирусы группы М (англ. main — основная) являются причиной более 90 % случаев ВИЧ-инфекции. Группу М классифицируют на несколько клад, называемых подтипами, также обозначаемых буквами:
- подтип A широко распространён, например, в Западной Африке и России[92];
- подтип B доминирует в Европе, Северной Америке, Южной Америке, Японии, Таиланде, Австралии[93];
- подтип C преобладает в Южной и Восточной Африке, Индии, Непале, некоторых частях Китая[93];
- подтип D обнаружен только в Восточной и Центральной Африке[93];
- подтип E не был выявлен в нерекомбинантном виде, лишь совместно с подтипом А как CRF01_AE в Юго-Восточной Азии[93];
- подтип F выявлен в Центральной Африке, Южной Америке и Восточной Европе[94];
- подтип G и рекомбинантная форма CRF02_AG выявлены в Африке и Центральной Европе[94];
- подтип H обнаружен только в Центральной Африке[94];
- подтип I был предложен для описания штамма-продукта множественной рекомбинации CRF04_cpx нескольких подтипов[95];
- подтип J распространён в Северной, Центральной и Западной Африке и странах Карибского бассейна[96];
- подтип K обнаружен только в Конго и Камеруне[94].
- подтип L обнаружен в Конго[97].
- Группа O (англ. outlier — непохожий) обнаружена в Центральной Африке и Западной Африке. Наиболее распространена в Камеруне, где в 1997 году более 2 % пациентов были заражены вирусом группы О[98] (около 100 000 человек, по данным на 2013 год)[99]. Вирусы этой группы не определялись ранними версиями тест-систем на ВИЧ-1; современные тесты определяют вирусы и группы О, и группы N[100].
- Группа N (англ. non-M, non-O — ни M, ни O) обозначает штаммы не М и не О, описана в 1998 году и обнаружена только в Камеруне. С 2006 года выявлены лишь 10 заражений вирусами группы N[101].
- Группа P — в 2009 году была определена нуклеотидная последовательность РНК ВИЧ, значительно сходная с вирусом иммунодефицита обезьян, описанным у горилл (SIVgor), но не с SIV, характерным для шимпанзе (SIVcpz). Вирус был выделен из образцов, полученных от женщины камерунского происхождения, проживающей во Франции[102][103][104].
ВИЧ-2
ВИЧ-2 идентифицирован в 1986 году[105], генетически очень близок к T-лимфотропному вирусу SIV, и в меньшей степени к вирусу ВИЧ-1. Геномы ВИЧ-1 и ВИЧ-2 имеют гомологию консервативных генов gag и pol около 60 %, и до 45 % для генов белков оболочки[106]. По состоянию на 2010 год, описано 8 групп ВИЧ-2, лишь группы A и B являются эпидемическими. Вирусы группы А распространены в Западной Африке, Анголе, Мозамбик, Бразилии, Индии и мало распространены в США и Европе[107][108]. Вирусы группы В распространены в Западной Африке[109][110].
Строение вириона

Вирионы ВИЧ имеют вид сферических частиц, диаметр которых составляет около 100—120 нанометров[111]. Это приблизительно в 60 раз меньше диаметра эритроцита[112]. В состав зрелых вирионов входит несколько тысяч белковых молекул различных типов.
Капсид зрелого вириона, состоящий из примерно 2000 молекул белка р24, имеет форму усечённого конуса[113].
Внутри капсида находится белково-нуклеиновый комплекс: две нити вирусной РНК, прочно связанные с белком нуклеокапсида p7, ферменты (обратная транскриптаза, протеаза, интеграза)[113]. С капсидом также ассоциированы белки Nef и Vif (7—20 молекул Vif на вирион). Внутри вириона (и, вероятнее всего, за пределами капсида) обнаружен белок Vpr[42]:8-11. Кроме того, с капсидом ВИЧ-1 (но не ВИЧ-2) связаны около 200 копий клеточного фермента пептидилпролилизомеразы A[англ.] (циклофилин А), необходимого для сборки вириона[114].
Капсид окружён оболочкой, образованной примерно 2000 молекул матриксного белка p17[113]. Матриксная оболочка, в свою очередь, окружена двуслойной липидной мембраной, являющейся наружной оболочкой вируса. Она образована молекулами фосфолипидов, захваченными вирусом во время его отпочковывания от клетки, в которой он сформировался[115]. В липидную мембрану встроены 72 гликопротеиновых комплекса Env, каждый из которых образован тремя молекулами трансмембранного гликопротеина gp41 (TM), служащего «якорем» комплекса, и тремя молекулами поверхностного гликопротеина gp120 (SU)[114]. С помощью белка gp120 вирус присоединяется к рецептору CD4 и корецептору, находящимся на поверхности Т-лимфоцитов человека. Стехиометрическое соотношение p24:gp120 в вирионе составляет 60—100:1[42]:11. При формировании наружной оболочки вируса также происходит захват некоторого количества мембранных белков клетки, в том числе человеческих лейкоцитарных антигенов (HLA) классов I и II и молекул адгезии[113][116].
Белки вириона интенсивно изучаются, поскольку являются мишенями разрабатываемых лекарств и вакцины против ВИЧ.
Функции важных структурных белков ВИЧ-1[113][116]
| Сокращение | Описание | Функции |
|---|---|---|
| gp41 (TM, transmembrane) | Трансмембранный гликопротеин массой 41 кДа | Располагается во внешнем слое липидной мембраны, играет роль «якоря», удерживающего молекулы белка gp120 |
| gp120 (SU, surface) | Гликопротеин массой 120 кДа | Наружный белок вириона. Нековалентно связан с трансмембранным белком gp41. С одной молекулой gp41 связаны 3—5 молекул gp120. Способен связывать рецептор CD4. Играет важную роль в процессе проникновения вируса в клетку. |
| p24 (CA, capsid) | Белок массой 24 кДа | Образует капсид вируса |
| p17 (MA, matrix) | Матриксный белок массой 17 кДа | Около двух тысяч молекул этого белка образуют слой толщиной 5—7 нм, располагающийся между внешней оболочкой и капсидом вируса. |
| p7 (NC, nucleocapsid) | Нуклеокапсидный белок массой 7 кДа | Входит в состав капсида вируса. Образует комплекс с вирусной РНК. |
Геном и кодируемые белки
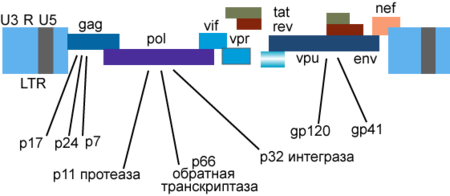
Генетический материал ВИЧ представлен двумя копиями положительно-смысловой (+)РНК[114]. Геном ВИЧ-1 имеет длину 9000 нуклеотидов. Концы генома представлены длинными концевыми повторами, которые управляют продукцией новых вирусов и могут активироваться и белками вируса, и белками инфицированной клетки.
9 генов ВИЧ-1 кодируют, по крайней мере, 15 белков[117]. Ген pol кодирует ферменты: обратную транскриптазу (RT), интегразу (IN) и протеазу (PR). Ген gag кодирует полипротеин Gag/p55, расщепляемый вирусной протеазой до структурных белков p6, p7, p17, p24. Ген env кодирует белок gp160, расщепляемый клеточной эндопротеазой фурином на структурные белки gp41 и gp120[42]:8-12. Другие шесть генов — tat, rev, nef, vif, vpr, vpu (vpx у ВИЧ-2) — кодируют белки, отвечающие за способность ВИЧ-1 инфицировать клетки и производить новые копии вируса. Репликация ВИЧ-1 in vitro возможна без генов nef, vif, vpr, vpu, однако их продукты необходимы для полноценной инфекции in vivo[118][119][120].
Gag
Полипротеин-предшественник Gag/p55 синтезируется с полноразмерной геномной РНК (которая в данном случае служит в качестве мРНК) в процессе стандартной кэп-зависимой трансляции, но возможна и IRES-зависимая трансляция. Предшественники функциональных белков располагаются в составе полипротеина Gag/p55 в следующем порядке: p17…p24…p2…p7…p1…p6[42]:8 (р1 и р2 — соединительные пептиды; другие продукты расщепления Gag/p55 описаны выше). Нерасщеплённый протеазой Gag/p55 содержит три основных домена: домен мембранной локализации (М, membrane targeting), домен взаимодействия (I, interaction) и «поздний» домен (L, late). Домен М, расположенный внутри области p17/МА, миристилируется (присоединяются остатки миристиновой кислоты) и направляет Gag/p55 к плазматической мембране. Домен I, находящийся внутри области p7NC (NC, nucleocapsid), отвечает за межмолекулярные взаимодействия отдельных мономеров Gag/p55. Домен L, также локализованный в области p7NC, опосредует отпочковывание вирионов от плазматической мембраны; в этом процессе участвует также р6 область полипротеина Gag/p55[42]:8[121].
Vpu
Двумя важными функциями белка Vpu являются: 1) разрушение клеточного рецептора CD4 в эндоплазматическом ретикулуме путём привлечения убиквитинлигазных комплексов и 2) стимуляция выделения дочерних вирионов из клетки путём инактивации интерферон-индуцируемого трансмембранного белка CD317/BST-2, получившего также название «tetherin» за его способность подавлять выделение вновь образовавшихся дочерних вирионов посредством их удержания на поверхности клетки[118][119][122][123][124][125].
Vpr
Белок Vpr необходим для репликации вируса в неделящихся клетках, в том числе макрофагах. Этот белок, наряду с другими клеточными и вирусными белками, активирует транскрипцию с использованием длинных концевых повторов генома ВИЧ в качестве промоторов. Белок Vpr играет важную роль в переносе вирусной ДНК в ядро и вызывает задержку деления клетки в периоде G2[126].
Vif
Белок Vif играет важную роль в поддержке репликации вируса. Vif индуцирует убиквитинилирование и деградацию клеточного антивирусного белка APOBEC3G, который вызывает деаминирование ДНК, приводящее к мутационным заменам G на A в вирусной ДНК, синтезируемой в ходе обратной транскрипции. Штаммы, лишённые Vif, не реплицируются в CD4+-лимфоцитах, некоторых линиях T-лимфоцитов и макрофагах. Эти штаммы способны проникать в клетки-мишени и начинать обратную транскрипцию, однако синтез вирусной ДНК остаётся незавершённым[126].
Nef
Белок Nef выполняет несколько функций. Он подавляет экспрессию молекул CD4 и HLA классов I и II на поверхности инфицированных клеток, и тем самым позволяет вирусу ускользать от атаки цитотоксических T-лимфоцитов и от распознавания CD4+-лимфоцитами. Белок Nef может также угнетать активацию T-лимфоцитов, связывая различные белки-компоненты систем внутриклеточной передачи сигнала[126].
У инфицированных вирусом иммунодефицита макак-резусов активная репликация вируса и прогрессирование болезни возможны только при интактном гене nef. Делеции гена nef были обнаружены в штаммах ВИЧ, выделенных у группы австралийцев с длительным непрогрессирующим течением инфекции[127]. Однако у части из них со временем появились признаки прогрессирования инфекции, в том числе снижение числа CD4+-лимфоцитов. Таким образом, хотя делеции гена nef и могут замедлять репликацию вируса, это не гарантирует полной невозможности прогрессирования заболевания[128].
Tat и Rev
Регуляторные белки Tat (транс-активатор) и Rev накапливаются в ядре клетки и связывают определённые участки вирусной РНК. Белок Tat имеет молекулярную массу около 14-15 кДа, связывает вторичную структуру геномной РНК вблизи 5'-нетранслируемой области[126][129], активирует обратную транскрипцию геномной РНК ВИЧ, синтез вирусных мРНК, необходим для репликации вируса почти во всех культурах клеток, регулирует выход вирионов из заражённых клеток[126][129], нуждается в клеточном кофакторе — циклине T1. Белок Rev регулирует экспрессию белков вириона, связывает мРНК гена env в области RRE (англ. Rev response element) интрона, разделяющего экзоны генов Tat и Rev[126][129].
Белки Tat и Rev стимулируют транскрипцию провирусной ДНК и транспорт РНК из ядра в цитоплазму, а также необходимы для трансляции. Белок Rev обеспечивает также транспорт компонентов вируса из ядра и переключение синтеза регуляторных белков вируса на синтез структурных[126].
Жизненный цикл
До проникновения в клетку-мишень
После попадания вирионов ВИЧ на поверхность и внутрь организма, вирусные частицы оказываются в различных по своей агрессивности биологических жидкостях. Слюна и желудочный сок содержат ферменты, которые в бо́льшей степени разрушают вирионы ВИЧ, чем другие биологические жидкости (это не относится к младенцам первых месяцев жизни, у которых ещё не вырабатываются соответствующие ферменты пищеварения, из-за чего младенцы могут быть заражены через грудное молоко). Вирионы ВИЧ проникают в кровеносную и лимфатическую систему организма и перемещаются по организму в потоке крови и лимфы. Оказавшись рядом с CD4-клеткой, вирионы ВИЧ присоединяются к рецептору CD4 на её плазматической мембране[130].
Проникновение в клетку и обратная транскрипция
| Механизм слияния вириона ВИЧ и плазматической мембраны Т-лимфоцита человека 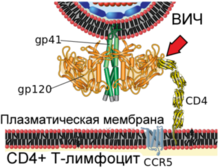   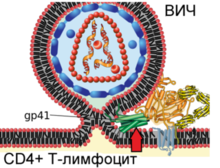 |
Вирусный гликопротеин gp120 прочно связывает рецептор CD4. В результате такого взаимодействия gp120 претерпевает конформационные изменения, которые позволяют ему также связать молекулу корецептора CXCR4 или CCR5 (экспрессируемых на поверхности Т-лимфоцитов, макрофагов, дендритных клеток и микроглии)[131][132]. В зависимости от способности связывать эти корецепторы, ВИЧ классифицируют на R5-тропные (связывают только корецептор CCR5), X4-тропные (связывают только корецептор CXCR4) и R5X4-тропные (могут взаимодействовать с обоими корецепторами) варианты[131]. При заражении, в основном, передаются R5-тропные и R5X4-тропные варианты[133]. Препараты, блокирующие корецепторы, могут быть эффективны против ВИЧ[134].
После описанных событий вирусный белок gp41 проникает в мембрану клетки и подвергается значительным конформационным изменениям, вследствие которых мембрана клетки и мембрана вириона ВИЧ сближаются друг с другом и затем сливаются. Вирусный белок gp41 очень важен для слияния мембран, поэтому его рассматривают в качестве мишени для разработки противовирусных препаратов.
После слияния мембран содержимое вириона проникает внутрь клетки. Внутри клетки вирусная РНК высвобождается из капсида. Затем под действием обратной транскриптазы происходит обратная транскрипция — процесс синтеза ДНК на основании информации в одноцепочечной геномной РНК вируса[135]. Большая часть лекарственных препаратов, одобренных для применения при ВИЧ-инфекции, направлена на нарушение работы обратной транскриптазы[8].
Транспорт вирусной ДНК в ядро и интеграция в геном
После завершения обратной транскрипции в CD4+-лимфоците вирусный геном представлен невстроенной ДНК. Для встраивания вирусной ДНК в геном клетки-хозяина и для образования новых вирусов необходима активация T-лимфоцитов. Активация CD4+-лимфоцитов происходит при их контакте с антигенпредставляющими клетками в лимфоидной ткани. Наличие вирусов на поверхности фолликулярных дендритных клеток и присутствие провоспалительных цитокинов (ИЛ-1, ИЛ-6 и ФНОα) способствуют размножению ВИЧ в инфицированных клетках. Именно поэтому лимфоидная ткань служит самой благоприятной средой для репликации ВИЧ[136].
Синтезированная вирусная ДНК транспортируется внутрь ядра клетки в составе пре-интеграционного комплекса, в который также входят белки ВИЧ p17/MA, Nef и интеграза[137]. Далее вирусная ДНК встраивается в хромосому активированного T-лимфоцита под действием интегразы. Несколько препаратов, ингибирующих интегразу, широко используются в современной комплексной антиретровирусной терапии. Вирусная ДНК, встроившаяся в хромосому клетки, называется провирусом[8].
Транскрипция, сплайсинг, транспорт РНК из ядра в цитоплазму и трансляция
В ядре клеточная РНК-полимераза синтезирует предшественник вирусных информационных РНК (мРНК), длина которого равна длине геномной РНК ВИЧ-1. Этот предшественник мРНК подвергается 5'-концевому кэпированию и 3'-концевому полиаденилированию. Кроме того, предшественник мРНК подвергается сплайсингу, в результате которого образуются более 40 разных мРНК, которые можно разделить на 3 класса[138]:
- несплайсированная РНК длиной около 9.3 kb — далее используется в качестве мРНК для синтеза белков Gag и Gag-Pol, а также в качестве геномной РНК;
- не полностью сплайсированные РНК размером около 4 kb — используются как мРНК для синтеза белков Vif, Vpr, Tat, Vpu и Env;
- полностью сплайсированные РНК размером около 2 kb — используются как мРНК для синтеза белков Vpr, Tat, Rev и Nef.
На ранней стадии экспрессии генов, в отсутствие белка Rev, несплайсированная и не полностью сплайсированные РНК ВИЧ-1 нестабильны и быстро разрушаются в ядре. В то же время полностью сплайсированные мРНК ВИЧ-1 являются стабильными и транспортируются из ядра в цитоплазму[138]. В цитоплазме с помощью рибосом происходит процесс трансляции — биосинтез белка из аминокислот по заданной матрице на основе генетической информации, содержащейся в мРНК. Синтезированный в цитоплазме белок Rev транспортируется в ядро, где связывается с областью RRE несплайсированной и не полностью сплайсированных РНК, что стабилизирует эти РНК. Кроме того, Rev взаимодействует с клеточным белком CRM1 (экспортин 1), и это взаимодействие стимулирует транспорт несплайсированной и не полностью сплайсированных РНК из ядра в цитоплазму, где происходит синтез закодированных в них белков[138].
Сборка и отпочковывание вирионов
Геномная РНК вируса, а также вирусные белки транспортируются к местам сборки вирионов — к мембране. Вирионы первоначально формируются из полипротеинов-предшественников структурных белков и ферментов и на этой стадии не являются инфекционными. В ходе созревания вирусной частицы вирусная протеаза расщепляет белки-предшественники до функциональных компонентов[8]. Несколько одобренных противовирусных препаратов ингибируют работу протеазы и препятствуют формированию зрелых вирионов[8].
Новые вирусные частицы отпочковываются от поверхности клетки, захватывая часть её мембраны, и выходят в кровяное русло, а клетка хозяина, несущая рецептор CD4, погибает[139][140]. Недавние исследования показали, что процесс отпочковывания вирионов может быть более сложным, чем считалось ранее. Так было обнаружено, что благодаря взаимодействию белка Gag с компонентами клетки вирионы накапливаются в особых внутриклеточных мультивезикулярных тельцах, которые обычно служат для экспорта белков. Таким образом вирусные частицы высвобождаются из клетки, эксплуатируя её собственную систему транспорта макромолекул[8].
Распространение по организму
Только что выделившийся из заражённого лимфоцита вирион ВИЧ в плазме крови живёт в среднем около 8 часов[130]. Продолжительность полужизни (время, за которое погибает 50 % вирионов ВИЧ) в плазме крови составляет примерно 6 часов[130]. В остальных средах продолжительность полужизни вирионов ВИЧ на порядки меньше[141].
В период острой фазы ВИЧ-инфекции отсутствие специфического иммунного ответа позволяет вирусу активно реплицироваться и достигать высоких концентраций в крови. Вирус заселяет органы лимфатической системы, CD4+-лимфоциты, макрофаги, а также другие клетки: альвеолярные макрофаги лёгких, клетки Лангерганса, фолликулярные дендритные клетки лимфатических узлов, клетки олигодендроглии и астроциты мозга и эпителиальные клетки кишки[142][143]. В лимфоидной ткани ВИЧ размножается на протяжении всего заболевания, поражая макрофаги, активированные и покоящиеся CD4+-лимфоциты и фолликулярные дендритные клетки[144][145]. Количество клеток, содержащих провирусную ДНК, в лимфоидной ткани в 5—10 раз выше, чем среди клеток крови, а репликация ВИЧ в лимфоидной ткани на 1—2 порядка выше, чем в крови. Основным клеточным резервуаром ВИЧ являются CD4+-Т-лимфоциты иммунологической памяти[146].
Для активации CD8+-лимфоцитов и образования антиген-специфических цитотоксических T-лимфоцитов необходима презентация пептидного антигена в комплексе с человеческим лейкоцитарным антигеном класса I. Дендритные клетки, необходимые для начала первичных антиген-специфичных реакций, захватывают антигены, перерабатывают и переносят их на свою поверхность, где эти антигены в комплексе с дополнительными стимулирующими молекулами активируют T-лимфоциты. Заражённые клетки часто не выделяют дополнительных стимулирующих молекул и поэтому не способны вызвать активацию достаточного числа B- и T-лимфоцитов, функция которых зависит от дендритных клеток[136].
На 2023 год ВИЧ-инфекция до сих пор остаётся неизлечимым заболеванием, так как геном вируса интегрируется в хромосомы клеток и может реактивироваться даже после курса антиретровирусной терапии. В настоящее время идёт поиск безопасных способов редактирования генома человека и исключения из него провирусной ДНК[147][148]. В 2014 году был предложен метод удаления генома ВИЧ-1 из заражённых клеток при помощи системы CRISPR/Cas9. С помощью этого метода исследователям удалось вырезать фрагмент провирусной ДНК, заключённый между 5'- и 3'-концевыми LTR-областями из хромосом заражённых клеток в культуре. Кроме того, этот метод оказался также эффективным для профилактики заражения неинфицированных клеток. Описанный подход может привести к разработке способа полного избавления от ВИЧ-инфекции[149][150].
Происхождение

HIV — вирус иммунодефицита человека
SIV — вирус иммунодефицита обезьян
Методом молекулярной филогении показано, что вирус иммунодефицита человека образовался в конце XIX или в начале XX века[151][152][153][154][155], скорее всего в 1920-х гг[156].
Оба типа вируса иммунодефицита человека ВИЧ-1 и ВИЧ-2 возникли в Западной и Центральной Африке южнее Сахары и передались от обезьян к людям. ВИЧ-1 возник на юге Камеруна в результате эволюции эндемичного вируса иммунодефицита обезьян SIV-cpz, который заражает черномордых шимпанзе (Pan troglodytes troglodytes)[157][158]. ВИЧ-1, как полагают, перешёл видовой барьер, по крайней мере, трижды и породил три группы вирусов: M, N и О[159].
ВИЧ-2 возник на территории Западной Африки (от южного Сенегала до запада Берега Слоновой Кости) в результате эволюции вируса иммунодефицита обезьян SIV-smm, который заражает тёмно-коричневых мангабеев (Cercocebus atys), представителя мартышкообразных узконосых обезьян[160].
Существует доказательство того, что охотники на диких животных (обезьян) или поставщики мяса в Западной и Центральной Африке подвергаются заражению вирусом иммунодефицита обезьян, причём вероятность заражения коррелирует с частотой взаимодействия с обезьянами и их мясом[161]. Однако вирус иммунодефицита обезьян — слабый вирус, и, как правило, подавляется иммунной системой человека в течение недели после заражения. Считается, что необходимо несколько передач вируса от человека к человеку в быстрой последовательности, чтобы вирусу хватило времени мутировать в ВИЧ[162]. Хотя передача вируса иммунодефицита обезьян от человека к человеку происходит редко, определённые социальные факторы могут существенно влиять на частоту заражений. Предполагают, что условия для распространения вируса были неблагоприятны в Африке до XX века. Сопоставление периодов ускоренной эволюции ВИЧ с социо-экономическими изменениями позволяет делать предположения о природе факторов, ускоривших распространение ВИО и ВИЧ.
Генетические исследования показывают, что последний общий предок ВИЧ-1 группы М существовал около 1910 года[163]. Сторонники этой даты связывают распространение ВИЧ с развитием колониализма в Африке и ростом больших городов. Эти факторы привели к таким социальным изменениям в обществе, как увеличение частоты беспорядочных половых связей, распространение проституции и заболеваний, передающихся половым путём (ЗППП)[164]. ЗППП, такие как сифилис, могут сопровождаться генитальными язвами. Исследования показывают, что вероятность передачи ВИЧ во время вагинального полового акта, достаточно низкая при обычных условиях, может быть увеличена в десятки, если не в сотни раз, если один из партнёров страдает от генитальных язв. О степени распространённости ЗППП в колониальных городах в начале 1900-х можно судить по следующим цифрам: в 1928 году по меньшей мере 45 % жительниц восточного Леопольдвиля (ныне — Киншаса, ранний центр распространения ВИЧ группы М) были проституированными женщинами, а в 1933 году около 15 % всех жителей этого же города были заражены одной из форм сифилиса. Ретроспективный анализ показал, что начало эпидемии ВИЧ-инфекции в Киншасе совпало с пиком эпидемии генитальных язв в середине 1930-х годов[164].
Альтернативная точка зрения гласит, что основным фактором, способствовавшим адаптации ВИЧ к людям и его распространению, была небезопасная медицинская практика в Африке в годы после Второй мировой войны, такая как использование нестерильных многоразовых шприцев при массовых вакцинациях, инъекциях антибиотиков и противомалярийных средств[110][165][166].
В результате ретроанализа образцов крови, взятых после Второй мировой войны, зафиксирован самый ранний документальный случай наличия ВИЧ в организме человека, кровь у которого взяли в 1959 году[167]. Вирус, возможно, присутствовал в Соединённых Штатах уже в 1966 году[168], но подавляющее большинство случаев заражения ВИЧ, идентифицированных за пределами тропической Африки, можно проследить до одного неустановленного человека, который заразился ВИЧ на Гаити, а затем перенёс инфекцию в США около 1969 года[169].
Мутация CCR5-Δ32
Естественная устойчивость к ВИЧ
Описаны случаи устойчивости людей к ВИЧ. Проникновение вируса в клетку иммунной системы связано с его взаимодействием с поверхностным рецептором, белком CCR5. Делеция (утеря участка гена) CCR5-дельта32 приводит к невосприимчивости её носителя к ВИЧ. Предполагается, что эта мутация возникла примерно две с половиной тысячи лет назад и со временем распространилась в Европе. Сейчас к ВИЧ фактически устойчив в среднем 1 % жителей Европы, 10—15 % европейцев имеют частичную сопротивляемость к ВИЧ[170]. 0,1-0,3 % русского населения почти невосприимчивы к ВИЧ[171]. Учёные Ливерпульского университета объясняют распространение мутации гена CCR5 тем, что она усиливает сопротивляемость к бубонной чуме. Эпидемия «чёрной смерти» 1347 года (а в Скандинавии ещё и 1711 года) способствовала увеличению частоты этого генотипа в Европе.
Мутация в гене CCR2 также уменьшает шанс проникновения ВИЧ в клетку и приводит к задержке развития СПИДа. Существует небольшой процент ВИЧ-положительных людей (около 10 %), у которых СПИД не развивается в течение долгого времени. Их называют нонпрогрессорами (nonprogressors)[172][173].
Важный клеточный компонент защиты против ВИЧ — антивирусный белок APOBEC3G, который вызывает деаминирование ДНК, приводящее к мутационным заменам G на A в вирусной ДНК, синтезируемой в ходе обратной транскрипции. APOBEC3G инактивируется белком Vif ВИЧ-1, который вызывает его убиквитинилирование и деградацию[174].
Обнаружено, что одним из главных элементов антивирусной защиты человека и других приматов является белок TRIM5a, способный распознавать капсид вирусных частиц и препятствовать размножению вируса в клетке. TRIM5a человека и шимпанзе несколько отличаются друг от друга и эффективны против разных вирусов: этот белок защищает шимпанзе от ВИЧ и родственных ему вирусов, а человека — от вируса PtERV1[175]. Обезьяны Нового Света, за исключением мирикины, которая имеет химерный ген TRIM5-CypA, устойчивостью к ВИЧ не обладают[176].
Другой важный элемент антивирусной защиты — интерферон-индуцируемый трансмембранный белок CD317/BST-2 (англ. bone marrow stromal antigen 2)[122][123][177]. CD317 — трансмембранный белок 2-го типа с необычной топологией: он имеет трансмембранный домен рядом с N-концом и гликозилфосфатидилинозитол (GPI) на С-конце, между которыми расположен внеклеточный домен[178]. Показано, что CD317 непосредственно взаимодействует со зрелыми дочерними вирионами, «привязывая» их к поверхности клетки[179]. Для объяснения механизма такого «привязывания» предложено несколько альтернативных моделей, которые, тем не менее, сходятся в следующем: молекулы CD317 формируют параллельный гомодимер; один или два гомодимера связываются одновременно с одним вирионом и клеточной мембраной. При этом с мембраной вириона взаимодействуют либо оба мембранных «якоря» (трансмембранный домен и GPI) одной из молекул CD317, либо один из них[179]. Спектр активности CD317 включает, по крайней мере, четыре семейства вирусов: ретровирусы, филовирусы, аренавирусы и герпесвирусы[177]. Активность данного клеточного фактора ингибируется белками Vpu ВИЧ-1, Env ВИЧ-2 и SIV, Nef SIV, гликопротеином оболочки вируса Эбола и белком К5 герпесвируса саркомы Капоши[118][119][124][125][177][180][181]. Обнаружен кофактор белка CD317 — клеточный белок ВСА2 (Breast cancer-associated gene 2; Rabring7, ZNF364, RNF115) — Е3-убиквитинлигаза класса RING. BCA2 усиливает интернализацию вирионов ВИЧ-1, «привязанных» белком CD317 к поверхности клетки, в CD63+ внутриклеточные везикулы с их последующим разрушением в лизосомах[182].
См. также
- Тимоти Рэй Браун («Берлинский пациент») — первый человек, который вылечился от ВИЧ/СПИДа.
- Роберт Рейфорд («нулевой пациент») — первая зарегистрированная жертва ВИЧ/СПИДа в Северной Америке.
- Арвид Ноэ — первая зарегистрированная жертва ВИЧ/СПИДа в Европе.
- Грете Раск — одна из первых жертв ВИЧ/СПИДа в Европе.
- Гаэтан Дюга — канадский бортпроводник, внёсший значительный вклад в распространение вируса в Северной Америке и ранее ошибочно идентифицировавшийся как «нулевой пациент».
Примечания
Литература
- ВИЧ 2014/2015
- Санитарные правила СП 3.1.5.2826-10 Профилактика ВИЧ-инфекции
- Методические рекомендации МР 3.1.0087-14 Профилактика заражения ВИЧ
- Леви Д. Э. ВИЧ и патогенез СПИДа / Джей Э. Леви; Пер. 3-го изд. с англ. Е. А. Монастырской; Под ред. Г. А. Игнатьевой ; Лаб. изучения опухолеродных вирусов и вирусов иммунодефицита человека, Мед. отделение и Научно-исслед. институт рака Калифорнийского университета, Мед. шк. Университета Калифорнии, Сан-Франциско, Калифорния. — М.: Научный Мир, 2010. — 736 с. — ISBN 978-5-91522-198-6.
- Малый В. П. ВИЧ/СПИД: (вирус иммунодефицита человека, синдром приобретённого иммунодефицита). — М.: Эксмо, 2009. — 672 с. — (Новейший медицинский справочник). — ISBN 978-5-699-31017-3.
- Покровский В. В. (редактор). ВИЧ-инфекция и СПИД: Национальное руководство. — М.: ГЭОТАР-Медиа, 2013. — 608 с. — ISBN 978-5-9704-2442-1.
- Bushman F.D., Nabel G.J., Swanstrom R. (Editors). HIV: From biology to prevention and treatment. — Cold Spring Harbor, New York, USA: Cold Spring Harbor Laboratory Press, 2012. — 572 с. — ISBN 978-193611340-8.
- Levy J.A. HIV and the pathogenesis of AIDS. — Third edition. — ASM Press, 2007. — 644 с. — ISBN 978-1-55581-393-2.
- Pancino G., Silvestri G., Fowke K. (Editors). Models of protection against HIV/SIV: Avoiding AIDS in humans and monkeys. — UK-USA-Canada: Academic Press, 2012. — 345 с. — ISBN 978-0-12-387715-4.
- Pepin J. The origins of AIDS. — New York, USA: Cambridge University Press, 2011. — 293 с. — ISBN 978-0-52118637-7.
- Prasad V.R., Kalpana G.V. (Editors). HIV protocols. — Humana Press, 2009. — 457 с. — ISBN 978-1-58829-859-1.
- Sax P.E., Cohen C.J., Kuritzkes D.R. (Editors). HIV essentials. — Jones and Bartlett Learning, 2012. — 248 с. — ISBN 978-1-4496-5092-6.
- Spearman P., Freed E.O. (Editors). HIV interactions with host cell proteins. — Springer, 2009. — 204 с. — ISBN 978-3-642-02174-9.
- Weeks B.B., Alcamo I.E. AIDS: The biological basis. — USA - Canada - UK: Jones and Bartlett Publishers, 2010. — 360 с. — ISBN 978-0-7637-6324-4.
Ссылки
- ВИЧ на curlie.org
- Второй в мире пациент полностью излечился от ВИЧ // Вести.ру, 11 марта 2020