Протонная терапия
Прото́нная терапи́я является одним из видов корпускулярной терапии (Particle therapy), которая использует пучок протонов высокой энергии для облучения больной ткани, наиболее часто при терапии рака.

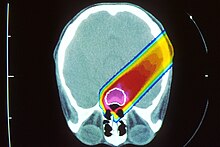
Физические принципы


Как и другие виды радиотерапии, облучение пучком протонов ставит целью избирательное уничтожение клеток больной ткани в результате взаимодействия ионизирующих частиц с веществом внутри клеток. Электрически заряженный протон, проникая в вещество, теряет свою энергию, преимущественно за счёт ионизации атомов и молекул. При достаточно большом числе актов ионизации это может приводить к непосредственной гибели клетки, в результате повреждения внутриклеточных мембран или воздействия образованных радиолизом химически активных радикалов. Либо происходит множественное повреждение ДНК, с которым не могут справиться механизмы её репарации, и клетка теряет способность к размножению[1].
В сравнении с фотонами (гамма-излучение) или лёгкими электронами тяжёлые заряженные частицы, такие как протоны и ещё более тяжёлые ионы, при торможении в веществе имеют характерную особенность зависимости энерговыделения от, собственно, энергии: чем медленнее движется ион, чем меньше его энергия, тем больше её выделяется на единицу пройденного пути. Зависимость энерговыделения от пройденного пути имеет ярко выраженный пик Брэгга вблизи полной остановки частицы. Пробег протона в веществе определяется его энергией, которую можно подобрать с таким расчётом, чтобы пик пришёлся на облучаемую ткань.
Благодаря большой массе при ионизации (электромагнитном взаимодействии с электронами атомов) протоны испытывают слабое поперечное рассеяние в ткани, разброс длины их пробега также мал. Пучок можно сфокусировать на опухоль во всех трёх направлениях, минимизируя повреждения окружающих здоровых тканей. Энергия протонного пучка выбирается в диапазоне 70 до 250 МэВ, что соответствует пробегу в воде до 38 см, то есть позволяет облучать опухоль в любой части организма. Ткани, расположенные до Брэгговского пика, получают некоторую дозу, меньшую, чем опухоль в пике, и значительно меньшую, чем при облучении фотонами. Более того, эта доза может быть ещё уменьшена за счёт прецизионного вращения либо самого пучка вокруг пациента с помощью специального устройства гантри[2], либо вращения пациента при фиксированном пучке протонов. Ткани, расположенные за Брэгговским пиком, практически не получают ионизационной дозы.
Для равномерного облучения объёмных опухолей используется композиция протонов разной энергии, которые образуют так называемый модицифицированный пик Брэгга (SOBP — Spread Out Bragg peak).

История
Впервые использовать для облучения протонный пучок предложил Роберт Уилсон в 1946 году[3]. Первые эксперименты по облучению пациентов были проделаны на ускорителях, построенных для физических исследований, в Радиационной лаборатории в Беркли (США) в 1954 и в лаборатории Сведберга[англ.] Уппсальского университета (Швеция) в 1957[4].
В 1961 году началось сотрудничество между Гарвардской циклотронной лабораторией[англ.] и Центральной больницей штата Массачусетс по развитию метода протонной терапии. Было пролечено 9116 пациентов вплоть до закрытия лаборатории в 2002 году[5]. Все терапевтические программы Гарвардской циклотронной лаборатории были перенесены в специально построенный центр протонной терапии Бостонской клиники.
В СССР терапевтический протонный пучок с энергией до 200 МэВ был получен на синхроциклотроне Объединённого института ядерных исследований (Дубна) в 1967 году. Пучок выводился в специализированное процедурное помещение, пристроенное к корпусу синхроциклотрона, где было размещено ротационное кресло для фиксации пациента, дозиметрическое, юстировочное и другое вспомогательное оборудование, предназначенное для контроля облучения пациентов[6].
В 1985 году создана международная некоммерческая организация PTCOG (Particle Therapy Co-Operative Group), объединяющая усилия по развитию протонной терапии[7]. Организация проводит регулярные международные конференции PTCOG (в 2022 году прошла 60-я) и школы, издаёт рецензируемый журнал International Journal of Particle Therapy[8].
В США в 1990 году на базе разработанного в Фермилабе компактного синхротрона[9] был построен специализированный клинический центр протонной терапии в городе Лома-Линда, штат Калифорния, Loma Linda University Medical Center (LLUMC[англ.]), поставивший лечение на поток. К 2005 году центр облучил свыше 10000 пациентов[10].
В 2007 году начал облучать пациентов первый компактный сверхпроводящий циклотрон, разработанный компанией ACCEL (в том же году поглощёна Varian Medical Systems)[11].
Методы
Применяются несколько разных подходов к терапии с использованием протонных пучков.
Метод «напролёт»
Метод стеретактической протонной терапии использует узкий пучок очень высокой энергии, пронзающий пациента насквозь. Используя 2 или более ракурсов, можно добиться получения достаточно высокой дозы для повреждения клеток в нужной области пересечения лучей при выживаемости окружающих тканей. Метод разрабатывался с 1950-х годов[12], однако сравнительно редко применяется и в 2000-х, например, в медицинском протонном центре ПИЯФ в Гатчине на 1 ГэВ синхроциклотроне СЦ-1000 для терапии аденомы гипофиза[13].
Широкий рассеянный пучок
Исторически "классическая" (с использованием пика Брэгга) протонная терапия использовала намеренно рассеянный пучок, создающий равномерное облучение широкой области. Для создания избирательности облучения опухоли применялись коллиматоры и дегрейдеры, создающие необходимый профиль пучка, изготавливаемые индивидуально для каждого поля облучения каждого пациента[14].
Фокусированный сканирующий пучок
С начала 1990-х годов наиболее распространён метод облучения сфокусированным "карандашным пучком"[англ.], который «закрашивает» опухоль управляемым отклонением в поперечном направлении, и вариацией его пробега в глубину изменением энергии протонов. Интенсивность пучка, определяющая дозу в каждой точке, также управляется согласно программе лечения[14]. Метод рутинно используется в медицинском центре PSI c 1996 года.
Флеш-терапия
FLASH-терапия — это новый подход к облучению как рентгеновскими лучами, так и пучками частиц, в том числе протонов, находящийся в стадии разработки и доклинических испытаний[15]. Экспериментально показано ещё в 1966 году[16], что выживаемость клеток зависит не только от полученной дозы ионизирующего излучения, но и от темпа поглощения этой дозы. Флеш-терапия подразумевает возможность облучения сверхвысокой дозой (десятки грей) в течение короткого импульса (миллисекунды). При этом облучение пациента может быть однократным, в то время как обычная процедура подразумевает разбиение полной дозы на десятки суточных фракций, с лимитом 2 Зв/фракцию. Биохимический механизм флеш-эффекта неясен и является предметом активного изучения.
К 2030 году в Объединенном институте ядерных исследований (ОИЯИ) в Дубне появится центр для проведения экспериментальных и клинических исследований в области ядерной медицины. Пилотной установкой и основой центра станет протонный медицинский ускоритель MSC-230, который построят уже в 2024 году. Одна из перспективных областей его применения — протонная флэш-терапия, позволяющая излечивать тяжелые онкологические заболевания за доли секунды.
— [17]

Оборудование
Для первых экспериментов с протонной терапией использовались уже имеющиеся ускорители, построенные для экспериментов по физике высоких энергий. Как правило, это были громоздкие синхроциклотроны на слишком высокую энергию, очень дорогие в эксплуатации, и непригодные для копирования. Так, например, синхроциклотрон терапевтического центра в Орсэ (Франция) имеет суммарную массу 900 тонн. Для протонной терапии с использованием пика Брэгга типичный диапазон энергий пучка от 70 до 250 МэВ[14], что соответствует магнитной жёсткости 2.4 Т*м. Такие энергии невозможно достичь в классическом циклотроне из-за релятивисткой поправки в частоте обращения, поэтому используют изохронные циклотроны или синхротроны, реже другие опции.
На февраль 2019 года по данным PTCOG (Particle Therapy Co-Operative Group), в мире, включая установки в научно-исследовательских институтах, действовали 92 протонных ускорителя, применяемых для лечения заболеваний. Большая часть из них работает в США (31), Японии (20) и Германии (8)[18].

Циклотроны
В большинстве центров для ускорения пучка используется изохронный циклотрон, в котором среднее поле возрастает с радиусом, а вертикальная устойчивость создаётся секторами с азимутальной вариацией магнитного поля[19]. Пучок ускоряется до максимальной энергии требуемого диапазона, например 250 МэВ, а вариация энергии осуществляется пропусканием пучка через специальную мишень, в которой протоны теряют энергию на ионизацию материала. Это является одним из главных недостатков циклотрона, накладывает дополнительные требования на радиационную защиту.
Для достижения максимальной энергии диаметр полюсов циклотрона достигает 3-5 метров, а масса от 200 до 300 тонн, что также ведёт к удорожаниям инфраструктуры и является существенным недостатком. Для снижения массы разработаны компактные сверхпроводящие изохронные циклотроны[20][21][22], с полем 2.4 Т и выше, и массой менее 100 тонн. Пучок из циклотрона квазинепрерывный, сгустки следуют с частотой ускоряющей ВЧ-системы, с высоким средним током в 1 мкА и выше, что является главным преимуществом циклотрона, позволяет быстро набирать необходимую дозу.
Синхроциклотроны также позволяют получать нужную энергию, однако в них ускорение происходит в импульсном режиме, хотя и с большой частотой, поскольку в цикле ускорения варьируется только частота ВЧ, но не ведущее поле. Тем не менее, импульсное ускорение до некоторой степени лишает циклотрон его главного преимущества.
Синхротроны
Синхротроны принципиально ускоряют пучок в импульсном режиме, причём время ускорения определяется не ВЧ системой (как в синхроциклотроне), а скоростью нарастания ведущего поля, поэтому достаточно велико, обычно составляет доли секунды, интенсивность в сгустке 1010-1011 протонов[23]. Соответственно, средний выпущенный ток не превышает 1 нА, что на порядки ниже возможностей циклотрона. Основное преимущество синхротрона — возможность выпуска на любой энергии, с малым разбросом по энергии в пучке. Также, магнитная система синхротрона лёгкая, не требует сверхпроводимости, с малым энергопотреблением. Для вывода пучка из синхротронов обычно применяется метод медленного резонансного выпуска.
Протонные синхротроны (а также синхроциклотроны), в отличие от изохронного циклотрона, могут быть использованы для ускорения более тяжёлых ионов, например, ионов гелия или углерода. Однако, из-за другого соотношения заряда к массе, требуется существенно большая магнитная жёсткость. Так, терапевтический пучок для углеродной терапии должен достигать энергии 450 МэВ/нуклон[24]. Поэтому синхротроны, ускоряющие разные виды ионов значительно габаритнее, дороже, и на практике используются только в центрах углеродной терапии.
Другие ускорители
Для протонной терапии в разное время предлагались FFAG-ускорители[25], линейные ускорители[26][27] и плазменные ускорители[28].

Прочее оборудование
Помимо ускорителя, необходим источник частиц; системы впуска и выпуска пучка; система нацеливания пучка, вращающая пучок вокруг пациента, так называемая гантри, которая для протонов является сложной дорогой и тяжёлой конструкцией[14]. Неотъемлемой частью систем протонной терапии является системы точного позиционирования пациента, а также контроля положения опухоли и критически важных органов, с использованием компьютерной томографии или плоских рентгеновских изображений.
Сравнение с другими видами радиотерапии

Рандомизованные исследования эффективности протонной терапии продолжаются до сих пор для разных видов рака[30] и показывают снижение частоты и последствий побочных эффектов сравнительно с другими видами лучевой терапии. Авторы из Стэнфордского университета опубликовали в 2020 году результаты исследования, выполненного на свыше чем 450 тысячах пациентов, из которых 5867 получили лечение протонным пучком[31]. Исследование показало трёхкратное снижение риска появления вторичных новообразований по всем видам рака, и 5-кратное для рака предстательной железы.
Главным преимуществом протонной терапии перед фотонной радиотерапией с модуляцией интенсивности (IMRT) является снижение побочных доз, получаемых здоровыми тканями, в особенности позади пика Брэгга. Таким образом, протонная терапия применяется чаще всего в случаях, когда опухоль расположена в тесном окружении жизнено важных органов (organs at risk — OAR): опухоли мозга, шеи, основания черепа. Также, предпочтение протонам часто отдаётся в случае лечения заболеваний у детей[32], поскольку большая ожидаемая продолжительность жизни и активно делящиеся клетки растущего организма требуют снижения побочных доз облучения[33].
Особым случаем является терапия онкозаболеваний глаз, таких как ретинобластома или меланома сетчатки. Поскольку облучаются ткани на небольшой глубине, не требуется высокая энергия пучка, достаточно 70 МэВ, что достигается на компактных дешёвых циклотронах. В связи с этим существует ряд центров, специализирующихся исключительно на облучении глаз, где протонная терапия стала "золотым стандартом" лечения меланомы сетчатки[34]. Лечение протонами глазных опухолей проводится в Сакраменто на построенном ещё в 1966 году изохронном циклотроне Калифорнийского университета в Дэвисе, с 1996 года пролечено свыше 1600 пациентов[35]. В Швейцарии в Институте Пауля Шерера, начиная с 1984 года, было пролечено около 7900 пациентов с опухолями глаза[36].
Протонная терапия в РФ
В России первоначально протонная терапия развивалась на базе нескольких ускорительных центров. Первый пациент был облучён в 1968 году пучком 660 МэВ синхроциклотрона ОИЯИ (г. Дубна)[12]. До 2000 года здесь было пролечено лишь около 150 пациентов, в период с 2000 по 2015 год чуть более 1000 пациентов. В 1969 году начата терапия на медицинском пучке ИТЭФ (г. Москва), на базе 10 ГэВ синхротрона У-10. До пожара в 2012 году, уничтожившего ускоритель, было пролечено 4320 пациентов[12]. С 1975 года началось лечение на пучке 1 ГэВ синхроциклотрона в ПИЯФ им. Б. П. Константинова, г. Гатчина, Ленинградская область. К 2014 году терапию здесь получили 1394 пациента[12]. Эти три центра могли принять лишь около 1 % всех нуждающихся в таком виде лечения.[источник не указан 1998 дней].
По современным консервативным оценкам 20 % всех больных, нуждающихся в лучевом лечении, получат существенный выигрыш при использовании протонной терапии. Для России это означает примерно 50 тысяч больных в год. Но, поскольку до настоящего времени на уровне доказательной медицины не определены локализации, где протонная терапия признавалась бы безальтернативным выбором, каждое государство, исходя из своих финансовых возможностей, формирует собственный перечень новообразований, при которых использование протонной терапии будет оплачено из средств бюджета.
— [37]
По состоянию на 2018 год в совокупности центры протонной терапии России могли пролечить не более 1150 пациентов в год. Стоимость лечения была доступна только для очень обеспеченной части населения[38]. Однако, с 2020 года протонная лучевая терапия для лечения онкологических заболеваний была включена в перечень видов высокотехнологичной медицинской помощи, финансируемой из средств Федерального фонда обязательного медицинского страхования[39].
МНРЦ имени А.Ф. Цыба (Обнинск)
В конце ноября 2015 года в МРНЦ имени А.Ф. Цыба (Обнинск) начато лечение больных на установке протонной терапии, расположенной в Протвино[40]. В конце марта 2016 года в самом Обнинске прошёл физический пуск ещё одного комплекса протонной терапии «Прометеус» на базе 250 МэВ компактного синхротрона, разработанного ЗАО Протом под руководством В.Е. Балакина[41]. К марту 2017 года пролечено 95 пациентов с опухолями головы и шеи[42][43]. Имеющийся однокабинный протонный комплекс, исходя из уже накопленного опыта, может лечить 400–500 человек в год при эксплуатации в две смены[источник не указан 304 дня].

Центр протонной терапии МИБС (Санкт-Петербург)
В 2015 году Медицинский институт имени Березина Сергея (МИБС) начал строительство в Санкт-Петербурге первого в РФ клинического центра протонной терапии с поворотной системой гантри, инвестировав 7,5 млрд рублей[44]. Центр оснащён циклотроном производства компании Varian Medical Systems[англ.] и двумя лечебными комнатами с поворотным гантри. Осенью 2017 года центр протонной терапии МИБС начал приём пациентов[45]. За первый полный год работы (2018) Центр МИБС пролечил почти 200 человек[46]. Плановая пропускная способность — 800 человек в год — достигнута в 2020 году. К сентябрю 2022 года пролечено 3000 пациентов, 40% которых моложе 18 лет[47].
Димитровградский радиологический центр
В сентябре 2019 года начал приём пациентов Центр медицинской радиологии в Димитровграде (ФГБУ ФНКЦРиО ФМБА России), Ульяновская область[48]. Плановая пропускная способность — 1200 пациентов в год. Оборудован центр системой компании IBA, включающей циклотрон и гантри[49]. Строительство центра сопровождалось многочисленными задержками и коррупционными скандалами, стоимость значительно возросла[50]. В 2021 году протонную терапию получили 800 пациентов центра[51].
Научно-исследовательские работы
В Обнинске, в МРНЦ имени А. Ф. Цыба ведутся методические исследования на действующей установке протонной терапии[52].
ЗАО Протом в Протвино продолжает производство установок «Прометеус», в том числе для отправки за рубеж[53][54].
В Протвино, Московская область, в Институте физики высоких энергий на базе ускорительного комплекса У-70 ведутся работы по созданию центра коллективного пользования для исследований лечения радиорезистентных опухолей с помощью пучка ускоренных ионов углерода (углеродная терапия)[55][56].
В Дубненском ОИЯИ исследуется новый метод повышения биологической эффективности медицинского пучка протонов. Изучено влияние ингибиторов — препаратов, используемых в онкологической клинике, на формирование двунитевых разрывов ДНК при облучении протонами в пике Брэгга. Применение предложенного способа, приводящего к повышению биологической эффективности пучков протонов, может сблизить области использования протонных и углеродных ускорителей для терапии[57].
Возможности протонной флеш-терапии исследуют в Институте ядерных исследований в Троицке на базе имеющегося 600 МэВ линейного протонного ускорителя[58].
В Институте ядерной физики СО РАН, Новосибирск, разрабатывают новые конструкции синхротронов для протонной терапии, с возможностью значительного повышения интенсивности[59], исследуют возможности применения электронного охлаждения[60].

Действующие и будущие центры протонной терапии в мире
Несмотря на долгую историю, протонная терапия стала широко применяться только с 2000-х годов. По информации PTCOG к 2023 году действует свыше 100 центров протонной терапии[61], общее число пациентов, облучённых протонами, превысило 300 тысяч[62]. Свыше 40 центров расположено в США, 25 функционируют в Японии, остальные распределены по другим развитым странам. В 14 центрах ведётся облучение ионами углерода. В России неоднократно объявлялось о строительстве новых центров протонной и ионной терапии[63][64][65][66][67], однако все эти планы были либо отменены, либо отложены[68]
Новые центры протонной терапии продолжают строиться по всему миру, однако их экономика остаётся неоднозначной. Стоимость многокабинного комплекса может превышать 200 млн. долларов[69]. Облучение протонным пучком обходится более чем в 2 раза дороже фотонной терапии[70]. Серьёзным потрясением для направления стала череда банкротств протонных центров, начиная с клиники в Сан-Диего[69]. Рассматриваются разные пути сделать экономически более привлекательной протонную терапию, преимущества которой с медицинской точки зрения хорошо обоснованны[71].

Поставщики оборудования
- IBA Proton Therapy (Бельгия)
- Still River Systems (США)
- Optivus Proton Therapy (США)
- Hitachi (Япония)
- Sumitomo Heavy Industries, (Япония)
- Varian, (США) (поглотила в 2007 году компанию ACCEL (Германия))
- Mitsubishi Electric, (Япония)
- ЗАО «ПРОТОМ» (Россия)
Примечания
Литература
- Костромин С. А. Ускорители в нашей жизни. «Встреча», газета, Дубна. 2013-03-14]
- Клёнов Г. И., Хорошков В. С., Черных А. Н. Ускорители для протонной лучевой терапии // Медицинская физика : журнал. — 2013. — № 4. — С. 5—17. — ISSN 1810-200X.
- Alberto Degiovanni, Ugo Amaldi. History of hadron therapy accelerators (англ.) // Physica Medica. — 2015. — Vol. 31. — P. 322. — doi:10.1016/j.ejmp.2015.03.002.
- Г. И. Клёнов, В. С. Хорошков. Адронная лучевая терапия: история, статус, перспективы // УФН. — 2016. — Т. 186. — С. 891—911. — doi:10.3367/UFNr.2016.06.037823.
- Гулидов И. А., Мардынский Ю. С., Балакин В. Е. и др. Новые возможности для протонной терапии в России // Вопросы онкологии. — 2016. — Т. 62, № 5. — С. 570—572. — ISSN 0507-3758.
- Thomas R. Bortfeld, Jay S. Loeffler. Three ways to make proton therapy affordable (англ.) // Nature : журнал. — 2017. — 28 September (vol. 549, no. 7673). — P. 451—453. — doi:10.1038/549451a.
- Мардынский Ю.С., Гулидов И.А., Гордон К.Б., Гоголин Д.В., Галкин В.Н., Каприн А.Д., Котухов И.И., Лепилина О.Г., Ульяненко С.Е. Первый опыт и ранние результаты протонной терапии активным сканирующим пучком в МРНЦ им. А. Ф. Цыба // Research'n Practical Medicine Journal : журнал. — 2017. — Апрель (№ Специальный выпуск). — ISSN 2410-1893.
- Marco Durante and Harald Paganetti. Nuclear physics in particle therapy: a review (англ.) // Reports on Progress in Physics : журнал. — 2016. — 19 август (vol. 79, no. 9). — doi:10.1088/0034-4885/79/9/096702.
- Елена Кокурина. Лечебная "подводная лодка" // В мире науки. — 2017. — № 8/9. — С. 40—48.
- Полякова Марина. Вспышка исцеления // Вестник Атомпрома : журнал. — 2023. — 27 апрель.
- Manjit Dosanjh. The changing landscape of cancer therapy // CERN courier. — 2018. — Январь.
Ссылки
- Лучевая терапия протонами и тяжёлыми ионами
- Mélanome oculaire (на французском).
- Antimatter could fight cancer, CERN Bulletin, 2006, №46.
- An overview of compensated and intensity modulated proton therapy, Tony Lomax, AAPM Summer School, Colorado Springs, June 2003.
- Протонная пушка в Троицке.
- Официальный сайт Медико-технического комплекса в Дубне
- Список центров протонной терапии