Ácido cloroáurico
| Ácido cloroáurico Alerta sobre risco à saúde | |||||||
|---|---|---|---|---|---|---|---|
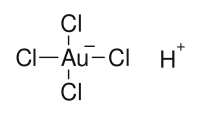 | |||||||
| Outros nomes | ácido tetracloroáurico tetracloro aurato(III) de hidrogênio tetracloro aurato | ||||||
| Identificadores | |||||||
| Número CAS | |||||||
| Propriedades | |||||||
| Fórmula molecular | HAuCl4 | ||||||
| Massa molar | 339,79 g/mol (forma anidra) 393.83 g/mol (tri-hidrato) | ||||||
| Aparência | cristais amarelo ouro higroscópico | ||||||
| Densidade | 3,9 g/cm3 (tri-hidrato) | ||||||
| Solubilidade em água | solúvel em água | ||||||
| Solubilidade | solúvel em álcool, éter | ||||||
| Riscos associados | |||||||
| Classificação UE | not listed | ||||||
| Principais riscos associados |
| ||||||
| Frases R | 34‐43 | ||||||
| Frases S | 26‐36/37/39‐45 | ||||||
| Compostos relacionados | |||||||
| Compostos relacionados | ácido cloroplatínico | ||||||
| Página de dados suplementares | |||||||
| Estrutura e propriedades | n, εr, etc. | ||||||
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas | ||||||
| Dados espectrais | UV, IV, RMN, EM | ||||||
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |||||||
Ácido cloroáurico é o composto de fórmula química HAuCl4. Ele é normalmente usado como fonte de ouro (Au) em experiências químicas. O ácido cloroáurico é o produto formado ao dissolver ouro em água régia, por exemplo, ao retirar ouro de componentes eletrônicos. O mesmo nome é usado para a forma anidra e para a forma tri-hidratada.
Obtenção e síntese
A maneira mais convencional e trivial de se obter o ácido cloroáurico é a dissolução de ouro elementar em água régia (uma mistura de três partes de ácido clorídrico para uma parte de ácido nítrico):[1]
Uma outra possibilidade é a reação entre cloreto áurico e ácido clorídrico:[1]
- Dissolução progressiva de ouro em água régia.
Propriedades
Propriedades físicas
Propriedades químicas
Reações
O tratamento alcalino do ácido cloroáurico, com uma base padrão, resulta na produção de sal metálico de tetracloro-ouro e água. O respectivo sal de tálio possui solubilidade baixa na maioria dos solventes. A combinação com amônio (sal quaternário de amônio) também é conhecida.[2] Outros sais de forma complexa são: [Au(bi-pir)Cl2][AuCl4][3] e [Co(NH3)6][AuCl4]Cl2.
A redução parcial do ácido produz dicloroaurato(I), [AuCl2]- (oxônio como contra-ião).[4]<--- (Ref. ERRADA??) Através de redução podem também ser produzidos outris compostos de coordenação do ouro(I), especiamente utilizando-se ligantes orgânicos. Frequentemente o próprio ligante serve como agente redutor, como é no caso da tioureia, (H2N)CS:
O ácido cloroáurico é o composto percursor na preparação de nanopartículas de ouro. Para precipitação destas agentes redutores, como por exemplo o tiosulfato (Na2S2O3), são usados.[5]
O aquecimento da forma hidratada (HAuCl4• n H2O) em uma corrente de gás cloro resulta em cloreto áurico (o cloreto de ouro (III), Au2Cl6).[6]
Anedota histórica
Durante a Segunda Grande Guerra, o químico húngaro residente na Dinamarca, George de Hevesy, laureado com o Prémio Nobel no ano de 1943, decidiu literalmente transformar as medalhas de pelo menos dois, também laureados, colegas (Max von Laue e James Franck) em ácido cloroáurico, dissolvendo-as em água régia, para escondê-las dos nazistas. E assim o fez, quando Copenhagen acabara de ser invadida. Após a guerra, o ouro foi recuperado e a Fundação Nobel generosamente refez as medalhas.[7]
Referências
Ligações externas
- «Chloroauric Acid» (em inglês). breve texto acadêmico com descrição e ilustrações







