Rak wątrobowokomórkowy
Rak wątrobowokomórkowy, pierwotny rak wątroby, rak (z) komórek wątrobowych, wątrobiak złośliwy (łac. carcinoma hepatocellulare, używany jest skrótowiec HCC od ang. hepatocellular carcinoma) – nowotwór złośliwy wątroby wywodzący się z hepatocytów. Stanowi od 80 do 90% pierwotnych nowotworów złośliwych wątroby[1][2][3].
| carcinoma hepatocellulare | |
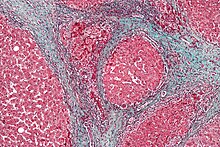
 Rak wątrobowokomórkowy u pacjenta z marskością wątroby na podłożu WZW C | |
| Klasyfikacje | |
| ICD-10 | C22.0 |
|---|---|
| ICDO | M8170/3 |
| MedlinePlus | |
| MeSH | |
Jest to trzeci nowotwór pod względem umieralności. Na świecie co roku jest przyczyną śmierci 500 000 osób przy zapadalności 600 000 osób rocznie. Wskaźniki zachorowalności różnią się geograficznie: najwyższe występują w Azji Południowo-Wschodniej, Chinach, Afryce Subsaharyjskiej, w Europie są znacznie niższe. Choroba najczęściej rozwija się na bazie marskości pozapalnej, której najważniejszymi czynnikami etiologicznymi są wirusowe zapalenie wątroby typu B i C. Oba wirusy odpowiadają za blisko 80% przypadków choroby. W krajach zachodnich ważną rolę odgrywają również alkoholowa marskość wątroby i niealkoholowe stłuszczenie wątroby.
Początkowo rak rozwija się skąpoobjawowo, a jego objawy są trudne do odróżnienia od zwykle towarzyszącej mu marskości wątroby. Do najważniejszych objawów klinicznych należy pogorszenie stanu ogólnego u chorego z marskością wątroby, ból w prawym podżebrzu, symptomy wynikające z cholestazy, żółtaczka, powiększenie wątroby oraz wodobrzusze. Rak przy spełnieniu określonych warunków i stwierdzeniu jego charakterystycznych cech może być rozpoznany na podstawie obrazu radiologicznego w tomografii komputerowej lub metodą rezonansu magnetycznego. W pozostałych przypadkach musi być wykonana biopsja, a bioptat poddany badaniu cytologicznemu. Badaniem przesiewowym wykonywanym co 6 miesięcy u wszystkich pacjentów z marskością wątroby jest ultrasonografia, natomiast oznaczenie α-fetoproteiny nie jest już zalecane w tym celu ze względu na duży odsetek wyników fałszywie dodatnich.
Wybór metody leczenia jest uzależniony od wyniku oceny stopnia zaawansowania choroby (stosuje się tak zwaną klasyfikację barcelońską) oraz od spełnienia dodatkowych kryteriów ważnych w danym sposobie terapii. Nowotwór ten można leczyć miejscowo – chirurgicznie lub niechirurgicznie – albo ogólnoustrojowo. Do metod leczenia chirurgicznego należą resekcja wątroby oraz przeszczepienie wątroby. Metody niechirurgiczne to terapie ablacyjne, z których najważniejszą rolę pełnią ablacja prądem o częstotliwości radiowej (RFA) i przezskórne wstrzyknięcie etanolu oraz chemioembolizacja (TACE). W leczeniu ogólnoustrojowym wykorzystuje się sorafenib. Radioterapia pełni rolę w leczeniu objawowym przerzutów. Chemioterapia nie jest zalecana ze względu na małą skuteczność i trudności w stosowaniu przy upośledzonej czynności wątroby.
Historia

Areteusz z Kapadocji w II wieku n.e. wywnioskował, że do choroby prowadzi, poprzez zmiany w konsystencji tkankowej (prawdopodobnie marskość wątroby), sekwencja zdarzeń zaczynająca się od zapalenia i obrzęku wątroby[4]. Od tego czasu aż do początku XIX wieku niewiele odkryto w tej dziedzinie. Gaspard Laurent Bayle jako pierwszy podał w Paryżu dokładny opis raka wątrobowokomórkowego i oszacował częstość jego występowania[5][4]. George Budd w połowie XIX wieku stwierdził, że rak wątrobowokomórkowy jest najczęstszą patologią organiczną wątroby u osób niebędących alkoholikami – prawdopodobnie błędnie rozpoznawał przerzuty jako pierwotne nowotwory wątroby[5][4]. Rudolf Virchow przedstawił szczegółowy opis różnic pomiędzy pierwotnymi i przerzutowymi nowotworami wątroby[6]. To jednak twierdzenie Virchowa, iż „narządy często dotknięte przerzutami są rzadko miejscem pierwotnego nowotworu”, znacznie opóźniło badania nad tą chorobą; nawet podawano w wątpliwości jej istnienie[5]. Mimo że dziś jest to piąty co do częstości nowotwór u mężczyzn, choroba ta przed XX wiekiem była bardzo rzadka – w 1901 roku H. Eggel podał, że opisano tylko 163 jej przypadki[7][8]. W 1911 roku K. Yamagiwa, M. Goldzieher i Z. Bokay opracowali klasyfikację histopatologiczną[6].
Do końca XIX wieku, mimo iż wcześniej przeprowadzano zabiegi operacyjne na wątrobie, nie podjęto prób leczenia chirurgicznego. Dopiero w 1897 roku Carl Langenbuch przeprowadził pierwszą planową i udaną resekcję guza wątroby[9]. W latach 50. XX w. w ramach postępowania chirurgicznego wprowadzono lobektomię, czyli resekcję całego płata wątroby, co zwiększyło skuteczność zabiegu. W tym samym czasie wprowadzono chemioterapię i radioterapię[10]. Ważnym wydarzeniem w historii leczenia raka był pierwszy udany przeszczep wątroby wykonany przez Thomasa Starzla w 1967, choć dopiero w latach dziewięćdziesiątych uznano wartość takiego postępowania w leczeniu raka wątrobowokomórkowego. Na początku lat 70. zastosowano embolizację naczyń guza, początkowo w leczeniu przerzutów raka wątrobowokomórkowego, a następnie guza pierwotnego[11]. Pod koniec lat 70. bezpośrednio do tętnicy wątrobowej podawano chemioterapeutyki[12][13][11], a następnie (w 1979 roku) wprowadzono chemioembolizację[14]. W latach 90. zaproponowano użycie ablacji prądem o częstotliwości radiowej w leczeniu guzów wątroby[15][16][17]. W 1999 roku opracowano klasyfikację barcelońską ważną dla stratyfikacji leczenia i prognozowania chorych[18][19]. W 2007 roku do leczenia wprowadzono sorafenib, który jest pierwszym skutecznym lekiem w terapii ogólnoustrojowej (zwanej też systemową)[20].
Epidemiologia

< 2,5
< 4,0
< 6,0
< 9,3
< 9,4
brak danych
Rak wątrobowokomórkowy na świecie u mężczyzn jest piątym, a u kobiet ósmym nowotworem pod względem częstości występowania[22][23][24]. Rocznie pojawia się ponad 600 000 nowych przypadków, wartość ta systematycznie wzrasta[1]. Z kolei pod względem umieralności na nowotwory HCC zajmuje trzecie miejsce na świecie i jest przyczyną około 500 000 zgonów rocznie[25]. Wskaźniki zachorowalności znacznie różnią się geograficznie. Najwyższe występują w Azji Południowo-Wschodniej, Chinach, Afryce Subsaharyjskiej (około 20–150/100 000), znacznie niższe w krajach wschodniej i południowej Europy oraz Japonii (około 5–20/100 000), a najniższe w Europie Zachodniej, Skandynawii oraz Stanach Zjednoczonych (poniżej 5/100 000)[26]. Szacuje się, że 80% przypadków choroby występuje w krajach rozwijających się, z czego aż 55% w samych Chinach[26]. W Polsce zapadalność na ten nowotwór wynosi około 2–3 tysięcy osób rocznie[1][27][28].
Mężczyźni chorują częściej od kobiet; proporcja liczby chorych mężczyzn do liczby chorych kobiet wynosi 2,4[26]. Rak wątrobowokomórkowy może występować w każdym wieku. W krajach o wysokiej zapadalności szczyt zachorowań najczęściej występuje między 20 a 40 rokiem życia, rzadko po 50 roku życia. W krajach o niskiej zapadalności występuje zwykle później: między 50 a 60 rokiem życia[22][1].
Etiologia i czynniki ryzyka
| Region | HBV | HCV | Alkohol | Inne |
| Europa | 10–15% | 60–70% | 20% | 10% |
| Ameryka Północna | 20% | 50–60% | 20% | 10%[a] |
| Azja (bez Japonii) | 70% | 20% | 10% | 10%[b] |
| Japonia | 10–20% | 70% | 10% | 10% |
| Afryka | 70% | 20% | 10% | 10%[b] |
Do rozwoju raka wątrobowokomórkowego w 80–90% dochodzi na podłożu marskości pozapalnej wątroby[1], której najistotniejszym czynnikiem etiologicznym jest wirusowe zapalenie wątroby typu B lub C, jak też ich ewentualne współwystępowanie[29]. Ocenia się, że blisko 80% przypadków raka jest spowodowane przez zakażenie HBV lub HCV[30]. Rola zapalenia wątroby typu D jest niejasna[27]. Istotnym problemem klinicznym są koinfekcje – HBV i HCV oraz HBV i HDV, które zwiększają ryzyko raka 2–6-krotnie[31]. W krajach zachodnich ważnymi czynnikami ryzyka są alkoholowa marskość wątroby i niealkoholowe stłuszczenie wątroby. Do czynników ryzyka należą również aflatoksyny zawarte w żywności, niektóre choroby metaboliczne, wieloletnie stosowanie doustnych środków antykoncepcyjnych, autoimmunologiczne zapalenie wątroby, pierwotne zapalenie dróg żółciowych, schistosomatoza, palenie tytoniu oraz czynniki genetyczne.
Marskość wątroby
W Europie i Ameryce Północnej zdecydowana większość raków wątrobowokomórkowych (80–90%[32]) rozwija się na podłożu marskości wątroby, natomiast w Azji prawie 50% przypadków rozwija się bez takiego związku[33][34].
Marskość wątroby jest to proces włóknienia miąższu wątroby i upośledzenia jej funkcji wywołany różnymi czynnikami, z których na pierwszy plan wysuwają się wirusowe zapalenie wątroby typu B i C oraz nadużywanie alkoholu. W miarę postępu procesu uszkodzenia wątroby dochodzi do aktywacji komórek gwiaździstych wątroby (komórki Ito) i przekształcenia się ich w komórki miofibroblastopodobne, które posiadają zdolność do produkowania macierzy pozakomórkowej. Jest to początkowy etap prowadzący do włóknienia wątroby[35]. Aktywowane komórki gwiaździste reagują na PDGF[36] i TGF-β[37], które stymulują włóknienie. PDGF może aktywować kaskady sygnalizacyjne MAPK i PI3K/Akt[38]. Kaskada MAPK reguluje wzrost i różnicowanie komórek, więc nadekspresja tej kaskady może mieć decydujące znaczenie dla powstawania raka[39]. Kaskada PI3K/Akt pełni ważną rolę w regulacji apoptozy i deregulacja tego szlaku jest istotna w kancerogenezie HCC[40]. Dochodzi również do skracania telomerów, co może wiązać się z niestabilnościami chromosomalnymi, co z kolei może prowadzić do utraty genów supresorowych[41]. Przewaga czynników przeżycia, które uniemożliwiają apoptozę hepatocytów z uszkodzonym DNA, aktywowane komórki gwiaździste oraz osłabiona funkcja komórek NK są czynnikami wystarczającymi dla rozwoju raka na podłożu marskości[42][38].
Wirusowe zapalenie wątroby typu B
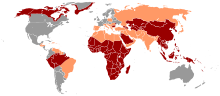
powyżej 8%
pomiędzy 2 a 7%
mniej niż 2%
Przewlekłe wirusowe zapalenie wątroby typu B, spowodowane przez przewlekłe zakażenie wirusem zapalenia wątroby typu B (HBV), jest ważnym czynnikiem etiologicznym raka wątrobowokomórkowego. Szacuje się, że przewlekłe zakażenie HBV odpowiada za 50–80% przypadków w krajach o wysokim ryzyku zakażenia, podczas gdy w krajach zachodnich o niskim ryzyku zakażenia tylko 20% przypadków można przypisać temu wirusowi[43]. Wśród chorych na raka wątrobowokomórkowego 15,4% posiadało antygen HBs, będący markerem zakażenia HBV[44]. Wysoka zawartość w osoczu DNA tego wirusa, odzwierciedlająca wysoki poziom jego replikacji, wiąże się ze zwiększonym ryzykiem raka[45][46][47]. Wiremia DNA HBV powyżej 10 000 kopii/ml (2000 IU/ml) jest silnym czynnikiem predykcyjnym rozwoju choroby, niezależnym od antygenu HBe, aminotransferazy alaninowej i marskości wątroby[45]. Genotyp C wirusa jest niezależnym czynnikiem ryzyka HCC[48][49]. Na terenach endemicznych u pacjentów z marskością pozapalną wywołaną przez HBV pięcioletnie skumulowane ryzyko raka wynosi 15%, a w Europie 10%[31].
Mechanizm, za pomocą którego zakażenie HBV powoduje raka, nie jest w pełni poznany. Proces karcynogenezy może być efektem bezpośredniego działania wirusa albo pośredniego oddziaływania poprzez zapalenie lub wpływ na proces regeneracji i włóknienia związanego z marskością wątroby. Wykazano, że DNA wirusa jest integrowany z chromosomami hepatocytów[43]. Integracja może być dokonana w krytycznych miejscach, które mają kluczowe znaczenie dla wzrostu komórki – zwykle miejsca włączenia DNA nie wydają się krytyczne. Ponadto długość i składniki włączanego materiału różnią się znacznie, a wirusowy DNA może zostać usunięty, zmieniony lub występować w niekodującej części materiału genetycznego. Sugeruje to, że nie jest to jedyny proces prowadzący do nowotworu[50][43].
Do rozwoju raka wątrobowokomórkowego przyczynia się produkt genu HBx, który jest czynnikiem transkrypcyjnym aktywującym wiele genów związanych z regulacją wzrostu oraz aktywacją szlaku kinazy RAS-RAF-MAP. Stwierdzono interakcje HBx z białkiem supresorowym p53[48].
Wirusowe zapalenie wątroby typu C
W krajach świata zachodniego aż 70% chorych na raka wątrobowokomórkowego jest zakażona wirusem zapalenia wątroby typu C (HCV)[28]. Nowotwór rozwija się po około 20–30 latach od zakażenia[1]. Zakażenie zwiększa 17-krotnie ryzyko zachorowania na ten nowotwór w porównaniu z osobami niezakażonymi[51]. Prawdopodobieństwo rozwoju raka wątrobowokomórkowego u osób zakażonych wynosi od 1% do 3% po 30 latach[52]. Roczne ryzyko rozwoju raka u pacjentów z marskością wątroby związaną z HCV wynosi 2–6% rocznie[53]. Czynnikami predysponującymi do rozwoju tego nowotworu u osób zakażonych HCV są: płeć męska, starszy wiek, koinfekcja HBV, nadmierne spożywanie alkoholu, cukrzyca oraz infekcja HCV związana z transfuzją krwi[52]. Występowanie raka wątrobowokomórkowego jest skorelowane z występowaniem włóknienia i marskości wątroby – bardzo rzadko stwierdzano go przy zakażeniu HCV bez obecnej marskości wątroby[51].
Powstawanie raka w konsekwencji zakażenia tłumaczy się wpływem wirusa na apoptozę i proliferacje hepatocytów oraz przewlekłym procesem zapalnym z następczymi procesami regeneracyjnymi[27]. Martwica hepatocytów i procesy mitotyczne zachodzące w wyniku przewlekłego zapalenia sprzyjają regeneracji guzkowej, a w odpowiednich warunkach dochodzi do dysplazji i raka[54].
Obecnie nie jest pewne, czy HCV jest onkogenny w sposób bezpośredni[55]. Wpływ taki nie jest jednak wykluczony, ponieważ u nosicieli nowotwór rzadko może rozwijać się bez występowania marskości wątroby[56]. Również rzadki rozwój raka u pacjentów z autoimmunologicznym zapaleniem wątroby (AZW) mimo rozwoju marskości również sugeruje onkogenną rolę HCV[57]. W badaniach na myszach wykazano, że białko rdzeniowe wirusa ma potencjał onkogenny[55][58]. Działanie białka rdzeniowego jest dwukierunkowe. Jednym z nich jest powodowanie poprzez dysfunkcje mitochondriów nadmiernego stresu oksydacyjnego oraz aktywacji układu wychwytującego obejmującego katalazy i glutation, co ostatecznie prowadzi do stłuszczenia wątroby[55][58]. Wirus wpływa na liczne kaskady sygnalizacyjne[55]. Prowadzi to do hamowania apoptozy i promowania proliferacji. Białko rdzeniowe wiąże się z kilkoma białkami supresorowymi nowotworów, w tym białkami p53, p73 i pRb[59][60]. Oddziałując z p73, zapobiega zatrzymaniu podziału zależnego od p53[61].
Białko rdzeniowe może modulować ekspresję białka p21, które jest głównym celem p53[62][63]. P21 jest silnym inhibitorem kinaz zależnych od cyklin (cyclin-dependent kinases, CDKs) i hamuje wzrost komórki. Białko rdzeniowe może wpływać na wzrost i proliferację poprzez wpływ na szlaki sygnałowe RAF/MAPK[64], Wnt/β-kateniny[65] i TGF-β[66].
Podobnie jak w kancerogenezie innych nowotworów nagromadzenie odpowiedniego wachlarza anomalii genetycznych jest konieczne do wieloetapowego rozwoju HCC, jednak zakażenie HCV pozwala pominąć niektóre z jej etapów[55].
Inne wirusowe zapalenie wątroby
Z pozostałych typów wirusowego zapalenia wątroby tylko HDV pełni rolę w patogenezie raka wątrobowokomórkowego[56]. Przewlekłe wirusowe zapalenie wątroby typu D, które jest powodowane przez HDV namnażający się wyłącznie w obecności HBV, jest czynnikiem ryzyka marskości wątroby i raka wątrobowokomórkowego[67]. Zakażenie HDV przyspiesza uszkodzenie wątroby, przyspieszając marskość i rozwój raka[56][31]. Wysokie poziomy wiremii u pacjentów bez marskości wątroby są związane ze znacznym ryzykiem rozwoju marskości i raka wątrobowokomórkowego[67].
Wirusowe zapalenie wątroby typu A i typu E nie prowadzą do przewlekłej choroby wątroby i nie mają potencjału onkogennego[56].
Alkohol

Przewlekłe spożywanie alkoholu zwiększa ryzyko raka wątrobowokomórkowego[69][70][71]. W Europie i Ameryce Północnej 80% przypadków choroby rozwija się na bazie marskości wątroby, gdzie alkohol jest jednym z najważniejszych czynników ryzyka, natomiast w Azji prawie 50% przypadków raka rozwija się bez marskości[33][34].
Patogeneza rozwoju raka na podłożu przewlekłego nadużywania alkoholu nie jest do końca poznana. Głównym jej warunkiem jest występowanie marskości wątroby. Postulowane mechanizmy rakotwórcze obejmują[72][73]:
- wytwarzanie aldehydu octowego – najbardziej toksyczny metabolit alkoholu, wiąże się z DNA
- wytwarzanie reaktywnych form tlenu poprzez cytochrom P450 CYP2E1
- zwiększenie aktywności prokarcynogenów przez cytochrom CYP2E1
- interakcje pomiędzy metabolizmem etanolu a retinolem i kwasem retinowym, w efekcie wzrost stężenia kwasu retinowego w wątrobie oraz innych toksycznych produktów pośrednich
- zaburzenie naprawy DNA
- współistniejące niedobory żywieniowe, w tym niedobór kwasu foliowego.
Zapadalność na raka wątrobowokomórkowego jest znacznie rzadsza niż w przypadków marskości pozapalnej[1][74].
Nie ustalono dokładnie dawki spożywanego alkoholu, przy której dochodzi do zwiększonego ryzyka raka. Przyjmuje się, że spożywanie 80 g alkoholu na dobę przez 10 lat zwiększa 5–8-krotnie ryzyko zachorowania[c][73][75][76][77]. Relacja między ilością spożywanego alkoholu a rakiem może nie różnić się u kobiet i mężczyzn[76][78]. Roczne ryzyko zachorowania wynosi około 1% i nie maleje w związku z abstynencją[73]. Dodatkowym problemem jest synergizm działania, szczególnie z wirusami hepatotropowymi. Konsumpcja alkoholu w przewlekłym zakażeniu HCV lub HBV podwaja ryzyko rozwoju nowotworu w porównaniu do samodzielnego działania wirusa[73][31][76]. Regularne[?] spożywanie 120 g alkoholu u pacjentów z marskością i zakażeniem HCV powoduje ryzyko wystąpienia raka wynoszące 40% po pięciu latach i 80% po dziesięciu latach, podczas gdy ryzyko u osoby niespożywającej alkoholu wynosiło odpowiednio 8% i 18%[33][79]. Wykazano, że w przewlekłym zakażeniu HCV spożywanie już 20 g alkoholu dziennie jest szkodliwe i zwiększa ryzyko zachorowania[33][80].
Niealkoholowe stłuszczeniowe zapalenie wątroby

Niealkoholowe stłuszczeniowe zapalenie wątroby (NASH) jest to rodzaj przewlekłego zapalenia wątroby, w którym u osób nie nadużywających alkoholu dochodzi do rozwoju zmian podobnych do obserwowanych w alkoholowym zapaleniu wątroby. NASH jest skutkiem progresji niealkoholowego stłuszczenia wątroby (NAFLD), stanowi czynnik ryzyka marskości wątroby oraz raka wątrobowokomórkowego. Niealkoholowe stłuszczenie wątroby jest związane z zespołem metabolicznym, otyłością, cukrzycą typu II oraz związaną z nią insulinoopornością[81]. W jej przebiegu dochodzi do akumulacji triglicerydów i kwasów tłuszczowych w cytoplazmie hepatocytów, a w wyniku rozwijającego się stresu oksydacyjnego dochodzi do utleniania kwasów tłuszczowych, wytwarzania cytokin prozapalnych i w 5–20% rozwija się niealkoholowe stłuszczenie wątroby[82], które może doprowadzić do marskości wątroby i raka wątrobowokomórkowego[83].
NASH jest uważane za najczęstszą przyczynę kryptogennego zapalenia wątroby[84]. Pacjenci z marskością o tej etiologii mają znacznie zwiększone ryzyko zachorowania na raka; szacuje się, że roczne ryzyko zachorowania na tę chorobę wynosi 2,6%[85].
Zarówno NAFLD, jak i NASH są częstymi schorzeniami w populacji krajów rozwiniętych. Szacuje się, że NAFLD dotyka 23–30% populacji, a cechy NASH można stwierdzić nawet u 5–20% populacji ogólnej[d][81][86].
Mechanizm rozwoju raka na podłożu NASH jest niejasny[87]. Nie wiadomo, czy marskość jest warunkiem rozwoju raka wątrobowokomórkowego, czy może on powstać także w nieobecności zmian marskich. Najbardziej prawdopodobny mechanizm karcynogenezy to progresja NASH do marskości, a następnie do raka[88]. Stłuszczenie wątroby samo w sobie ma potencjał rakotwórczy[87]. W patogenezie tego nowotworu bierze się pod uwagę otyłość z insulinoopornością (insulina, działająca poprzez IGF, aktywuje kinazy aktywowane mitogenami (MAPK)[89] i stymuluje zrost komórek), otyłość z hiperestrogenemią[87], stres oksydacyjny[90][91], poziom adiponektyny i leptyny[92].
Karcynogeneza w NASH może być częściowo związana bezpośrednio z otyłością[93] i cukrzycą typu II, która 2–3-krotnie zwiększa ryzyko zachorowania na raka[94][95]. Cukrzyca typu II w skojarzeniu z zakażeniem HCV zwiększa aż 37-krotnie ryzyko choroby[94][96][87].
Aflatoksyna
Aflatoksyny to rodzaj mykotoksyn wytwarzanych głównie przez grzyby z rodzaju Aspergillus – Aspergillus flavus i Aspergillus parasiticus. Grzyby te występują w orzechach ziemnych, zbożu, migdałach w wilgotnych rejonach tropikalnych[97]. Wysoka temperatura i wilgotność sprzyjają rozwojowi tych grzybów.
Regiony, w których spożycie aflatoksyn jest wysokie, cechuje również wysoka częstość zakażeń HBV, co utrudnia badania epidemiologiczne[97]. Nie wiadomo, jak dużą rolę miałaby pełnić aflatoksyna w patogenezie choroby.
Aflatoksyna w wątrobie ulega metabolizmowi do reaktywnych, karcynogennych metabolitów, które mogą wiązać się z DNA i powodować zmiany poprzedzające mutacje genetyczne[98][99][100]. Wykazano, że przewlekła ekspozycja na aflatoksyny jest czynnikiem ryzyka wystąpienia HCC[101][98]. Wiele badań wskazuje na efekt addycyjny z HBV[102][103][104] oraz HCV[105][106][107]. Aflatoksyny mogą pełnić rolę sprawczą w 4,6–28,2% przypadków HCC na świecie[105].
Choroby metaboliczne

Niektóre dziedziczne choroby metaboliczne predysponują do zachorowania na raka wątrobowokomórkowego. Do najważniejszych chorób metabolicznych zwiększających to ryzyko należą: hemochromatoza pierwotna, niedobór alfa1-antytrypsyny, tyrozynemia typu I, porfirie, choroba von Gierkego, choroba Wilsona.
Pierwotna hemochromatoza jest to dziedziczna choroba metaboliczna, w której dochodzi do nadmiernego wchłaniania żelaza z pożywienia, a następnie do jego akumulacji w wielu narządach. W wyniku choroby rozwija się zwłóknienie wątroby i w konsekwencji zmiany marskie. Choroba znacznie zwiększa prawdopodobieństwo zachorowania, szacuje się, że zwiększa ryzyko względne od 20 do 200 razy[108][109][110].
Niedobór α1-antytrypsyny jest chorobą uwarunkowaną autosomalnie recesywnie, w której w wyniku niedoboru brakuje silnego inhibitora proteaz serynowych. Mechanizm uszkodzenia wątroby wiąże się z akumulacją w siateczce śródplazmatycznej hepatocytów nieprawidłowej cząstki α1-antytrypsyny[111][112]. Choroba jest związana ze zwiększonym ryzykiem, szczególnie u mężczyzn, zachorowanie na HCC, pięciokrotnie zwiększając ryzyko zachorowania[113][112].
Tyrozynemia jest chorobą uwarunkowaną autosomalnie recesywnie, w której występuje niedobór enzymu szlaku metabolicznego tyrozyny. W wyniku nagromadzenia produktów pośrednich dochodzi do ostrej niewydolności wątroby w okresie niemowlęcym lub przewlekłej choroby prowadzącej do marskości wątroby i zwiększonego ryzyka raka wątrobowokomórkowego[114]. Ryzyko raka jest bardzo wysokie, rozwija się on aż u 40% pacjentów po 2 roku życia już w dzieciństwie[115][112].
Porfirie są to zaburzenia uwarunkowane genetycznie związane z nieprawidłową syntezą hemu. Ostra porfiria przerywana (AIP) wiąże się z 30-krotnie podwyższonym ryzykiem zachorowania[116][112]. W porfirii skórnej późnej (PCT), która jest związana z podostrym zapaleniem wątroby i marskością, również występuje zwiększone ryzyko raka[117][112].
Choroba von Gierkego jest glikogenozą dziedziczoną w sposób autosomalny recesywny. Polega ona na braku glukozo-6-fosfatazy, enzymu niezbędnego w procesie glukoneogenezy. Około 30% pacjentów w drugiej lub trzeciej dekadzie życia rozwijają się gruczolaki wątroby[112][118]. U niektórych pacjentów rozwija się rak wątrobowokomórkowy[119][120].
Choroba Wilsona to choroba uwarunkowana autosomalnie recesywnie spowodowana nieprawidłowym metabolizmem miedzi, gromadzeniem jej w różnych tkankach, prowadząca do ich uszkodzenia. Choroba jest czynnikiem ryzyka raka wątrobowokomórkowego[121]. Uważa się, że karcynogeneza jest efektem gromadzenia się miedzi w wątrobie i jej marskości, co prowadzi do raka[121].
Leki antykoncepcyjne i gruczolak
Długotrwałe stosowanie doustnych środków antykoncepcyjnych jest związane z rozwojem łagodnych guzów wątroby: gruczolaka wątrobowokomórkowego, naczyniakami i ogniskowym rozrostem guzkowym[122]. Badany jest związek doustnej antykoncepcji z rozwojem nowotworów złośliwych wątroby (w tym HCC)[123]. Nie jest jasne, czy jej stosowanie zwiększa ryzyko gruczolaka i czy łagodne nowotwory nią spowodowane mogą się przekształcić w nowotwór złośliwy. W literaturze są odnotowane pojedyncze przypadki (14 opisanych[123]) ogniskowej złośliwej transformacji gruczolaka do HCC u kobiet przyjmujących środki antykoncepcyjne[124]. Wyniki badań statystycznych są sprzeczne. Dodatkowo nie uwzględniają preparatów nowej generacji ze zmniejszoną ilością hormonów[123]. W metaanalizie wykazano, że nie ma zwiększonego ryzyka raka wątrobowokomórkowego przy stosowaniu krótszym niż 5 lat[125][123].
Schistosomatoza
Schistosomatoza to choroba pasożytnicza powodowana przez przywry z rodzaju Schistosoma (S. haematobium, S. mansoni, S. intercalatum, S. japonicum i S. mekongi), występuje endemicznie w tropikalnych obszarach Afryki, Azji i Ameryki Południowej. Tylko Schistosoma japonicum została sklasyfikowana jako potencjalnie karcynogenna dla ludzi[126]. Niektóre badania sugerują, że przywra jest kofaktorem w zakażeniu HBV czy HCV, nie będąc podstawowym karcynogenem[127].
Palenie papierosów wpływa na ryzyko raka wątrobowokomórkowego. Jest to efekt metabolizmu w wątrobie wielu związków rakotwórczych zawartych w dymie papierosowym[128]. W prospektywnym badaniu kohortowym wykazano, że osoby palące miały 3-krotnie zwiększone ryzyko raka wątrobowokomórkowego[129][123]. Istnieje zależność ryzyka zachorowania od ilości wypalonych papierosów i długości trwania nałogu[129][130]. Jest ono zależne od płci (u kobiet jest mniejsze niż u mężczyzn[131]), czynników genetycznych (istnieją pacjenci mniej podatni na skutki palenia: nie zwiększa ono u nich ryzyka zachorowania na tego raka[132]), zakażenia HCV (zwiększenie ryzyka HCC[133]) i spożycia alkoholu u pacjentów otyłych (synergizm działania[128]). Palenie tytoniu u osób chorujących na raka zwiększa ryzyko śmierci[134].
Autoimmunologiczne zapalenie wątroby

Autoimmunologiczne zapalenie wątroby (AZW) jest to choroba autoimmunologiczna polegająca na przewlekłym, postępującym procesie martwiczo-zapalnym wątroby o nieznanej etiologii. Zapalenie może prowadzić do marskości wątroby. Ryzyko raka wątrobowokomórkowego jest stosunkowo niskie w porównaniu z innymi przewlekłymi chorobami wątroby, szczególnie o etiologii wirusowej i alkoholowej[135][123]. Warunkiem karcynogenezy jest wystąpienie marskości wątroby[135]. Szacuje się, że rak może wystąpić u 7% pacjentów z AZW o co najmniej 5-letnim okresie trwania choroby[136].
Pierwotne zapalenie dróg żółciowych
Pierwotne zapalenie dróg żółciowych (PBC) jest to choroba autoimmunologiczna polegająca na zniszczeniu drobnych wewnątrzwątrobowych przewodzików żółciowych, a w konsekwencji powodująca cholestazę i odczyn zapalny, co może prowadzić do marskości wątroby. PBC jest związany ze zwiększonym ryzykiem raka wątrobowokomórkowego[137]. Mężczyźni są narażeni na raka w każdym stadium choroby[138].
Czynniki genetyczne
Wywiad rodzinny raka wątrobowokomórkowego u krewnych pierwszego stopnia wiąże się z czterokrotnym zwiększeniem ryzyka zachorowania[139][140].
Czynniki ryzyka
Czynnikami ryzyka rozwoju raka wątrobowokomórkowego są[1]:
- przewlekłe zakażenie WZW B
- przewlekłe zakażenie WZW C
- marskość wątroby
- alkoholizm
- niealkoholowe stłuszczeniowe zapalenie wątroby (NASH)
- spożywanie żywności zanieczyszczonej aflatoksynami[141]
- niektóre choroby metaboliczne:
- hemochromatoza
- niedobór α1-antytrypsyny
- tyrozynemia
- porfiria skórna późna i ostra porfiria przerywana
- choroba von Gierkego
- choroba Wilsona
- autoimmunologiczne zapalenie wątroby (AZW)
- pierwotne zapalenie dróg żółciowych
- palenie tytoniu[141]
- schistosomatoza i zakażenia przywrą chińską
- polimorfizm genu EGF[142]
Zapobieganie
Zapobieganie rakowi wątrobowokomórkowemu polega na modyfikacji czynników ryzyka. Jedną z najważniejszych jego przyczyn jest przewlekłe zakażenie wirusami hepatotropowymi – HBV i HCV. Bardzo istotnym elementem profilaktyki raka jest szczepionka przeciw wirusowemu zapaleniu wątroby typu B (HBV), którą wprowadzono w 1981 roku[143]. Międzynarodowa akcja szczepień przeciw HBV spowodowała zmniejszenie zachorowań na raka wątrobowokomórkowego[144]. Badania przeprowadzone w Tajwanie wykazały, że szczepienia przeprowadzone wśród dzieci spowodowały zmniejszenie zachorowalności w tej grupie wiekowej o 70%[145]. Szczepionkę przeciw HBV można uznać za pierwszą „szczepionkę przeciwrakową”. Obecnie 80–90% dzieci z Azji Wschodniej i Południowo-Wschodniej jest już zaszczepionych, w związku z czym za 30–50 lat (okres, jaki musi minąć od zakażenia, by doszło do wystąpienia raka) można spodziewać się znacznego zmniejszenia zachorowalności na raka wątrobowokomórkowego[146][147]. W Polsce obowiązkowe szczepienie niemowląt wprowadzono w 1996 roku, w 2000 roku wprowadzono szczepienie u nieszczepionej młodzieży w wieku 14 lat[148]; w związku z masowym programem szczepień obserwuje się tendencję spadkową częstości występowania HBV w Polsce[149].
W przypadku wirusowego zapalenia wątroby typu C (HCV) nie opracowano szczepionki, więc bardzo istotne jest zapobieganie infekcji. Zakażenie następuje poprzez płyny ustrojowe. Najczęstszą drogą zakażenia HCV są zabiegi medyczne[141]. Ryzyko zakażenia drogą seksualną jest stosunkowo niskie[150][151], obecność zakażenia wśród partnerów w długotrwałym związku wynosi około 4%[152][153][154], a ryzyko zakażenia partnera w długotrwałym związku wynosi, według różnych źródeł[141], od 1% do 11%. Ryzyko jest znacznie większe w sytuacji przypadkowych kontaktów seksualnych[155], kontaktów homoseksualnych (szczególnie MSM)[156], koinfekcji HIV[156][157][158].
W krajach o istotnym ryzyku narażenia na aflatoksyny stosuje się środki przeciwgrzybicze oraz fungicydy[147].
Profilaktyką wtórną HCC jest badanie przesiewowe chorych ze zwiększonym ryzykiem choroby.
Objawy kliniczne
Zwykle rak wątrobowokomórkowy rozwija się bezobjawowo (we wczesnych stadiach jest to 40% przypadków[1][3]) lub skąpoobjawowo. Początkowe objawy są mało charakterystyczne i trudne do odróżnienia od marskości wątroby[3]. W bardziej zaawansowanym etapie może występować pogorszenie funkcji wątroby bez uchwytnej przyczyny z obecnością żółtaczki, wodobrzusza i encefalopatii wątrobowej. W znacznym zaawansowaniu choroby pojawia się ból brzucha, utrata masy ciała, brak łaknienia (zespół kacheksja-anoreksja), osłabienie. Do objawów klinicznych należą[3]:
- pogorszenie stanu ogólnego u chorego z marskością wątroby
- ból w prawym podżebrzu, tępy, o niewielkim nasileniu
- wzdęcia, biegunka, zaparcia, brak łaknienia
- objawy wynikające z cholestazy: świąd skóry, żółtaczka, powiększenie wątroby i śledziony, zmiana zabarwienia stolców
- żółtaczka – nasilenie żółtaczki nie koreluje z zaawansowaniem nowotworu[3]
- powiększenie wątroby i wyczuwalny guz w prawym podżebrzu
- wodobrzusze.
W badaniach dodatkowych stwierdza się następujące odchylenia[1]:
- wzrost aktywności fosfatazy zasadowej (ALP)
- wzrost aktywności gamma-glutamylotranspeptydazy (GTTP)
- wzrost stężenia α-fetoproteiny (AFP).
Niekiedy komórki nowotworowe wytwarzają aktywne biologicznie związki będące przyczyną zespołów paraneoplastycznych[1]. Zespoły te nie są rzadkie w raku wątrobowokomórkowym i zwykle wiążą się z gorszym rokowaniem[159]. Należą do nich:
- hipercholesterolemia – występuje u około 25% chorych i związana jest z wyższym zaawansowaniem choroby i gorszym rokowaniem[160][161]
- hiperkalcemia – występuje u około 5,3% chorych i jest związana z wyższym zaawansowaniem choroby i gorszym rokowaniem[160]. Może być pierwszym objawem choroby[162][163]. Hiperkalcemia może wynikać z produkcji białka PTH-podobnego (PTHrP) przez komórki nowotworowe[164] lub obecności przerzutów do kości.
- erytrocytoza – występuje u około 3,9% chorych, jest spowodowana zwiększonym wydzielaniem erytropoetyny. Jej występowanie nie jest związane z większym zaawansowaniem choroby[160][165].
- hipoglikemia – jest związana ze wzrostem IGF-II, nie obserwuje się wzrostu stężenia insuliny[166][167][168]. Hipoglikemia może również być spowodowana zaawansowaną dysfunkcją wątroby.
- choroby demielinizacyjne[169][170][171][172]
- zapalenie mózgu i rdzenia kręgowego[173]
- pęcherzyca[174][175]
- zapalenie wielomięśniowe[176][177][178] – możliwy związek z zakażeniem HCV[179]
- zapalenie skórno-mięśniowe – rzadko[180][181], również jest podejrzewany związek z zakażeniem HCV[182][183]
- zapalenie wielostawowe[184]
- trombocytoza – jest efektem wzmożonego wydzielania trombopoetyny[185]
- rybia łuska nabyta[186]
- liszaj śluzowaty[187]
- nabyta porfiria (ostra porfiria przerywana – PCT)[188][189][190]
- acanthosis nigricans maligna[191].
Patomorfologia


Tylko 20% nowotworów złośliwych wątroby stanowią pierwotne nowotwory tego narządu, w większości to guzy przerzutowe. Wśród pierwotnych guzów wątroby 80–90% raków stanowi rak wątrobowokomórkowy[2].
Makroskopowo guz może być duży i jednoogniskowy, wieloogniskowy złożony z wielu guzków o różnej wielości lub w postaci raka rozlegle inwazyjnego – rozlegle naciekającego miąższ wątroby, zajmując niemal cały narząd[192]. Postać wieloguzkowa i rozlegle inwazyjna jest trudna do odróżnienia od guzków regeneracyjnych. Rak wątrobowokomórkowy jest słabo odgraniczonym guzem, koloru zielonkawo-szarego, żółtobiaławego[193], ze względu na niewielką ilość zrębu jest miękki. Często są obecne wylewy krwawe. Zmiany mają dużą skłonność do naciekania naczyń, w efekcie występują liczne przerzuty wewnątrzwątrobowe oraz często są obecne masy nowotworowe wrastające do żyły wrotnej i blokujące krążenie wrotne lub penetrujące żyłę główną dolną. Czop może sięgać do prawego przedsionka[192].
Mikroskopowo obraz raka wątrobowokomórkowego może być różnorodny. Dobrze i średnio zróżnicowane guzy są zbudowane z komórek przypominających hepatocyty, które odtwarzając układy hepatocytów, tworzą sznury lub wyspy. W wysoko dojrzałych można znaleźć kuleczki żółci w kanalikach rzekomych utworzonych pomiędzy komórkami. W cytoplazmie mogą występować kwasochłonne wtręty podobne do ciałek Mallory’ego. Guzy o niskim stopniu dojrzałości są zbudowane z dużych pleomorficznych lub małych drobnych komórek[192][193].
Szczególnym wariantem jest rak włóknisto-blaszkowy. Jest to nowotwór występujący równie często u kobiet, jak i mężczyzn, cechujący się brakiem związku z marskością i innymi typowymi czynnikami ryzyka raka wątrobowokomórkowego, jednak z lepszym rokowaniem. Zwykle jest to pojedynczy, duży guz z pasmami tkanki łącznej, przypominający ogniskowy rozrost guzkowy wątroby. Budują go dojrzałe, wieloboczne komórki zlokalizowane w gniazdach lub beleczkach, oddzielonych blaszkami z gęsto upakowanych wiązek kolagenu[192].
Historia naturalna choroby
Historia naturalna choroby jest uzależniona od charakterystyki wzrostu guza oraz przebiegu marskości wątroby. Guz jest najczęściej wykrywany jako pojedyncza, powoli rosnąca zmiana[194], ale w co najmniej 30% przypadków jest wykryty w fazie zmiany wieloogniskowej[195]. Zmiany wieloguzkowe są częstsze u chorych z wieloma czynnikami ryzyka niż u chorych z pojedynczym czynnikiem[196]. Rak charakteryzuje dość szeroki zakres czasu podwojenia wielkości guza, który waha się od 1 do 20 miesięcy z medianą 4-6 miesięcy[197][198][195]. Z tego powodu część pacjentów może umrzeć z powodu postępu i powikłań marskości wątroby, a nie w efekcie choroby nowotworowej[7]. Unaczynienie raka początkowo jest ubogie i pochodzi z naczyń wrotnych, następnie w wyniku intensywnej neoangiogenezy staje się zarterializowane, zależne od tętnicy wątrobowej. Krew odprowadzają naczynia pochodzące od naczyń wrotnych. Opisano tworzenie się połączeń tętniczo-wrotnych i tętniczo-żylnych, które stanowią drogę o niskiej odporności na oderwane fragmenty guza i pomagają mu przetrwać i rozprzestrzeniać się[7]. W dużym badaniu sekcyjnym wykazano, że w 56% przypadków raka wątrobowokomórkowego obserwuje się cechy naciekania naczyń, a tylko w 4% przypadków naciekanie dróg żółciowych[199]. Prawdopodobieństwo naciekania naczyń zależy od wielkości guza oraz od makroskopowego typu choroby[200]. Częściej dochodzi do naciekania naczyń wrotnych niż odgałęzień żyły wątrobowej[7]. Przebieg kliniczny zwykle we wczesnych fazach jest skąpo- lub bezobjawowy, w zaawansowanym może wystąpić bolesne powiększenie wątroby lub żółtaczka[195]. Nowotwór daje przerzuty do płuc (najczęstsza lokalizacja[201]), węzłów chłonnych, otrzewnej, nadnerczy i kości, rzadziej do innych narządów[202][203]. Najczęściej przyczyną śmierci chorych jest progresja choroby rozrostowej (63%), 8% umiera z powodu niewydolności wątroby, 10% z powodu krwawienia do przewodu pokarmowego, 2% w związku z powikłaniami po przeszczepie wątroby, 7% z nieznanych przyczyn[53][195]. Główną przyczyną zgonu jest progresja zmian wewnątrzwątrobowych, a nie przerzuty odległe[202].
Diagnostyka

Rozpoznanie raka wątrobowokomórkowego jest stawiane na podstawie nieinwazyjnych badań diagnostycznych lub badania histopatologicznego. Biopsja i badanie histopatologiczne nie są konieczne do rozpoznania choroby u pacjentów z marskością i zmianą powyżej 2 cm z typowym obrazem radiologicznym w TK lub MRI (wzmocnienie w fazie tętniczej oraz wymywanie kontrastu w fazie wrotnej)[2]. Diagnostyka zmiany poniżej 2 cm stanowi duży problem diagnostyczny[204][205]. W przypadku zmian o wielkości 1–2 cm wystarczy zastosowanie jednej techniki obrazowania, ale w sytuacji suboptymalnych warunków oceny zmiany jest zalecane zastosowanie dwóch metod obrazowania. Badanie dwiema technikami obrazowymi charakteryzuje się dużą swoistością[206], jednak niską czułością, wynoszącą około 30%[207][2]. Oznacza to, że większość zmian musi być weryfikowana histopatologicznie. Wykonanie sekwencyjnie dwóch badań obrazowych zwiększa czułość badania[208]. W przypadku wykrycia zmiany poniżej 1 cm u pacjenta z marskością wątroby należy powtarzać badania obrazowe co cztery miesiące[e][2][209], wynika to z niskiego ryzyka złośliwości, trudności w wykonaniem biopsji i interpretacji wyników przez histopatologa[210]. Zaleca się regularne monitorowanie zmiany aż do czasu osiągnięcia rozmiarów powyżej 1 cm lub uzyskania atypowych cech[210][207]. W przypadku wzrostu zmiany schemat postępowania jest identyczny jak w sytuacji nowo wykrytej zmiany. Rola ultrasonografii ze wzmocnieniem kontrastowym (contrast-enhanced ultrasound, CEUS) i angiografii jest kontrowersyjna. PET nie jest badaniem odpowiednio czułym dla wczesnej diagnozy.
Badania obrazowe
Badania obrazowe odgrywają kluczową rolę w diagnostyce raka wątrobowokomórkowego. Postęp technologiczny pozwolił na lepsze scharakteryzowanie zmian w wątrobie. Jednak wykrywanie raka u pacjentów z marskością wątroby oraz różnicowanie raka wątrobowokomórkowego od zmian łagodnych czy nowotworów przerzutowych nadal pozostaje trudnym zadaniem[211]. Podobną wartość diagnostyczną mają metody tomografii komputerowej i rezonansu magnetycznego[212][213].
Tomografia komputerowa (TK)
Podstawowym badaniem w wykrywaniu i różnicowaniu raka wątrobowokomórkowego jest wielofazowa spiralna tomografia komputerowa[214]. Konieczne jest uzyskanie obrazu z fazy tętniczej, fazy żyły wrotnej i równowagi. Guz jest bogato unaczyniony głównie poprzez gałęzie z tętnicy wątrobowej, dlatego obraz ognisk raka ulega wzmocnieniu podczas fazy tętniczej lub 2-40 s po infuzji kontrastu[211][214]. Otaczający guz prawidłowy miąższ większość krwi otrzymuje poprzez żyłę wrotną[215], co jest widoczne 50-90 s po infuzji kontrastu (faza wrotna, wrotno-miąższowa)[214]. Część nowotworów jest ubogo unaczyniona, dotyczy to przypadków raka nisko zróżnicowanego oraz wysoko zróżnicowanego we wczesnych postaciach, w których jeszcze nie doszło do rozwoju intensywnego unaczynienia. W tych przypadkach guz jest widoczny w fazie wrotnej. W fazie równowagi można ocenić wiele czynników prognostycznych, w tym obecność torebki rzekomej[214]. Faza tętnicza pozwala wykryć około 95% przypadków raka wątrobowokomórkowego, a faza wrotna około 80% przypadków[216].
Rak w TK cechuje się niejednorodną strukturą, co odzwierciedla zwłóknienie, stłuszczenie, martwicę oraz zwapnienia. Wysycenie nowotworu może różnić się od pozostałego miąższu i wówczas ognisko jest hipodensyjne. Często są obecne zmiany satelitarne[211][214]. Zmiany włókniste lub z torebką wykazują opóźnione wzmocnienie[217].
Trudności diagnostyczne sprawia różnicowanie nowotworu od zmian powstałych w przebiegu marskości wątroby – guzków regeneracyjnych i dysplastycznych. Guzki regeneracyjne w TK są widoczne jako obszary hiperdensyjne, w MRI w obrazach T2-zależnych jako ciemne obszary (hipointensywne). Guzki dysplastyczne cechują się wzmocnieniem kontrastowym w TK i MRI i brakiem wypłukania kontrastu w fazie wrotnej. W przypadku raka dochodzi do szybkiego wypłukania kontrastu przy jednoczesnej obecności wzmocnienia torebki. Nowotwór powstały w guzku dysplastycznym daje obraz wzmocnienia guzka dysplastycznego z jednoczesnym częściowym wypłukaniem kontrastu w obszarze raka – obraz guza w guzie[218].
Angio-TK jest najbardziej przydatnym narzędziem do oceny naciekania naczyń wątrobowych oraz oceny ewentualnych przetok tętniczo-wrotnych i tętniczo-wątrobowych[219][1].
Rezonans magnetyczny (MRI)
Badanie metodą rezonansu magnetycznego ma podobną czułość jak tomografia komputerowa, w niektórych ośrodkach jest to badanie z wyboru. Ogniska raka w obrazach T1-zależnych jest hipointensywne, a w T2-zależnych jest hiperintensywne[214]. Istnieje zależność zróżnicowania histologicznego i sygnału w MRI, intensywność sygnału w obrazach T2-zależnych wzrasta wraz ze stopniem złośliwości guza[220].
Badanie dynamiczne po dodaniu środka kontrastowego (kontrastu gadolinowego, zwanego gadoliną) przebiega podobnie do badania dynamicznego w TK. Faza tętnicza uwidacznia zmiany dobrze unaczynione, a faza wrotna zmiany ubogo unaczynione. W przeciwieństwie do raka łagodne guzki regeneracyjne i guzki dysplastyczne większość krwi otrzymują z żyły wrotnej[215]. Wzmocnienie zmiany w fazie wrotnej utrzymującej się do fazy równowagi przemawia za łagodnym charakterem zmiany.
Duże guzy powyżej 5 cm często mogą zawierać tkankę tłuszczową i torbiele o wysokiej zawartości białka. MRI w projekcji T1-zależnej jest bardziej czułe od TK w wykrywaniu tkanki tłuszczowej i różnicowaniu torbieli[1].
Ultrasonografia (USG)

Ultrasonografia ze względu na niską czułość u pacjentów z marskością wątroby w znacznym stopniu została zastąpiona przez tomografię komputerową i obrazowanie metodą rezonansu magnetycznego. W dużych zmianach ultrasonografia odznacza się wysoką czułością i swoistością, jednak jest mniej wiarygodna dla zmian mniejszych, w których można by zaoferować leczenie radykalne. Dla zmian 3–5 cm czułość wynosi około 80–95%, a w zmianach o wielkości 1 cm już tylko 60–80%[221].USG z kontrastem (CEUS) w postaci helu i dwutlenku węgla może pozwolić poprawić czułość badania[222][223][224][211]. W optymalnych warunkach badania metoda może wykazywać porównywalną skuteczność w diagnostyce zmian w wątrobie[225]. CEUS może być używany w początkowym etapie diagnostycznym, jednak złotym standardem pozostają TK i MRI[226]. Ultrasonografia dopplerowska ułatwia odróżnienie zmian łagodnych lub przerzutowych od raka wątrobowokomórkowego, w którym typowo są widoczne wzory rozgałęzień naczyń z prędkością przepływu większą niż przy zmianach łagodnych lub przerzutowych. USG doplerowskie pomaga wykryć w żyle wrotnej małe skrzepliny związane z inwazją guza[211][227][228]. Ultrasonografia nadaje się do zastosowania u pacjentów z przeciwwskazaniami do tomografii komputerowej: uczulonych na jodowe środki kontrastowe, z niewydolnością nerek oraz pacjentek w ciąży[229].
Angiografia
Angiografia jest stosowana głównie do oceny anatomii wątroby przed operacją lub chemioembolizacją[211].
Pozytonowa tomografia emisyjna
Pozytonowa tomografia emisyjna (PET) ma ograniczone zastosowanie jako narzędzie diagnostyczne w raku wątrobowokomórkowym. Badanie ma niską czułość wykrywania raka[230] i nie ma przewagi nad TK[231]. Znakowana fluorem glukoza może być wykorzystywana do monitorowania leczenia[232].
Glukoza znakowana fluorem (18F-FDG) nie jest znacząco wychwytywana przez komórki nowotworowe. Jest ona wychwytywana przez komórki o wysokim poziomie metabolizmu. Dobrze zróżnicowane guzy oraz przerzuty mogą nie wykazywać odpowiednio dużego poziomu przemian metabolicznych, który odróżniałby je od otaczających tkanek. Nowe radiofarmaceutyki – octan znakowany węglem-11 (11C-octan) i cholina znakowana węglem-11 lub fluorem-18 (11C-cholina, 18F-fluorocholina) – mogą pomóc zwiększyć czułość badania. Znakowany octan jest znacznikiem, który zostaje wbudowany w obrębie błony komórkowej i bierze udział w procesach energetycznych komórki[233]. Może być używany do wykrywania przypadków wysoko zróżnicowanego raka wątrobowokomórkowego, w których nie dochodzi do odpowiednio wysokiego wychwytu znakowanej glukozy (FDG)[230]. W przypadkach niskiego wychwytu 11C-octanu obserwuje się wzrost wychwytu glukozy, dlatego niektórzy badacze zalecają jednoczesne stosowanie znakowanej glukozy oraz 11C-octanu[234] lub 18F-fluorocholiny[235]. Zastosowanie 11C-choliny jest ograniczone krótkim okresem półtrwania (20 minut) i koniecznością posiadania cyklotronu[214].
Biopsja wątroby i badanie histopatologiczne

Rozpoznanie histopatologiczne jest stawiane na podstawie oceny próbek pobranych podczas biopsji gruboigłowej, diagnostycznej laparaskopii lub preparatu po operacji.
Biopsja i badanie histopatologiczne nie są konieczne do rozpoznania choroby u pacjentów z marskością i zmianą powyżej 2 cm z typowym obrazem radiologicznym w TK lub MRI (wzmocnienie w fazie tętniczej oraz wymywanie kontrastu w fazie wrotnej)[2][236]. Rozpoznanie histopatologiczne jest zalecane we wszystkich przypadkach raka wątrobowokomórkowego bez związku z marskością oraz w przypadkach niejednoznacznych w marskości wątroby[237]. Czułość biopsji waha się w zależności od lokalizacji i wielkości zmiany, wynosi 70–90%[2][205][238]. Ujemny wynik badania histopatologicznego nie wyklucza rozpoznania. Powtórna biopsja jest zalecana w przypadku niejednoznacznego wyniku, wzrostu guza lub w sytuacji zmiany profilu wzmocnienia kontrastowego w badaniach obrazowych. Biopsja wątroby niesie ryzyko rozsiewu zmiany poza wątrobę, którego całkowite ryzyko ocenione w metaanalizie wynosi 2,7%[239][2].
α-fetoproteina (AFP)
α-fetoproteina (AFP) jest to białko płodowe, produkowane głównie przez komórki płodowej wątroby oraz pęcherzyka żółtkowego (struktura zarodkowa). Jego stężenie fizjologicznie wzrasta u ciężarnych. Funkcja AFP u ludzi dorosłych pozostaje nieznana. Białko jest markerem nowotworowym, jego podwyższone stężenie może towarzyszyć rakowi wątrobowokomórkowemu, również niektórym guzom zarodkowym (nienasieniakom: rakowi zarodkowemu, rakowi pęcherzyka żółtkowego) i gruczolakorakom płuca, jajnika, żołądka[221][240]. Podwyższony poziom AFP może również występować podczas regeneracji wątroby w przebiegu przewlekłego lub ostrego uszkodzenia[1].
Stężenie AFP nie wykazuje ścisłej korelacji ze stopniem zaawansowania raka wątrobowokomórkowego. Nie zawsze w przypadku raka obserwuje się podwyższone stężenia markera, prawidłowe stężenie AFP może występować nawet u 40% chorych[1]. Badanie stężenia AFP charakteryzuje się czułością 41–65% i swoistością 80–94% dla stężenia 20 ng/dl[240][241]. AFP wraz z USG było badaniem przesiewowym w kierunku raka wątrobowokomórkowego. Samo badanie stężenia AFP zwiększa wykrywalność w 6–8% przypadków niezidentyfikowanych wcześniej przez USG[2]. Jest to związane z faktem, że wzrost AFP towarzyszy jedynie 10–20% przypadków raka we wczesnym stadium[2]. Problematyczne jest ustalenie punktu odcięcia. Dla wartości 20 ng/ml test jest bardziej czuły, ale mniej swoisty; dla wartości 200 ng/ml wzrasta swoistość kosztem obniżenia (do około 20%) czułości[242]. Słabo zróżnicowanym, bardziej agresywnym guzom częściej towarzyszy wysokie stężenie AFP[211].
Stężenie AFP może mieć znaczenie rokownicze. Wykazano, że stężenie powyżej 400 ng/ml koreluje z większym rozmiarem guza, zajęciem dróg żółciowych, zakrzepem żyły wrotnej i zmniejszoną przeżywalnością. Podwyższenie stężenia AFP we wczesnym stadium choroby jest związane z bardziej agresywną postacią choroby[243]. Białko może również służyć do monitorowania leczenia. Brak spadku stężenia może wskazywać na niepełną resekcję (okres półtrwania od 3 do 5 dni)[211][244], a stopniowy wzrost może oznaczać nawrót. Prawidłowy poziom AFP nie wyklucza nawrotu ani niedoszczętności zabiegu[211].
Obecnie nie zaleca się rutynowego badania poziomu AFP u chorych z grupy ryzyka raka wątrobowokomórkowego w ramach badania przesiewowego[2][1]. Wzrost wykrywalności o 6–8% nie rekompensuje dużej liczny wyników fałszywie dodatnich (nawet 7,5%)[2][245][246]. AFP nie pełni już roli w diagnostyce[206]. Oznaczenie AFP ma jedynie znaczenie w przypadku stwierdzenia zmiany ogniskowej o niejasnym charakterze w sytuacji niemożliwości wykonania badania histopatologicznego[1].
Badane potencjalne markery
- Heterogenność AFP – ustalono, że AFP występuje w trzech izoformach: AFP-L1, AFP-L2 i AFP-L3. Izoforma AFP-L3 występuje tylko u chorych na raka wątrobowokomórkowego. Jej wartość nie koreluje z AFP i markery mogą być stosowane niezależnie. Przy wartości frakcji AFP-L3 wynoszącej 5% AFP czułość badania wynosiła 47,2% w porównaniu z czułością 38% dla badania stężenia AFP całkowitego[247]. Dla wartości 15% frakcji czułość wynosi już 97% przy swoistości 92%[248]. AFP-L3 może być przydatnym markerem w połączeniu z AFP, zwiększając jego specyficzność w diagnostyce[249].
- α-l-fukozydaza (AFU) – jest to enzym lizosomalny występujący w wielu tkankach. Jego zwiększone stężenie obserwuje się w raku wątrobowokomórkowym. Stężenie enzymu nie koreluje z wielkością guza ani ze stężeniem AFP[250]. Badanie może pozwolić wykryć nowotwór nawet 6-9 miesięcy wcześniej niż USG. Niestety specyficzność fukozydazy w diagnostyce raka jest niska, enzym ulega nadekspresji u pacjentów z cukrzycą, przewlekłym zapaleniem trzustki i niedoczynnością tarczycy, ponadto aktywność jest zależna od pochodzenia etnicznego[240].
- D-gamma karboksyprotrombina (DCP) – jest to nieprawidłowa, nieczynna biologicznie protrombina, powstaje w wyniku niedostatecznie wydajnej reakcji karboksylacji zależnej od witaminy K. U chorych na raka wątrobowokomórkowego poziom DCP jest znacznie wyższy niż w przypadku przewlekłego zapalenia wątroby czy marskości. Marker charakteryzuje się niską czułością, szczególnie w wykrywaniu guzów poniżej 3 cm, co ogranicza jego rolę w diagnostyce[240].
- Antygen raka płaskonabłonkowego (SCCA) – jest to inhibitor proteazy serynowej, chroni komórki nowotworowe przed apoptozą. Wykazano, że jego ekspresja jest znacznie wyższa w raku wątrobowokomórkowym (93%) oraz zmianach dysplastycznych (100%) w porównaniu z guzkami regeneracyjnymi (30%)[251]. Badanie charakteryzuje wysoka czułość (84%) i niska swoistość (46%), co jest komplementarne z badaniem stężenia AFP[252]. SCCA może być cennym dodatkowym markerem w diagnostyce raka wątrobowokomórkowego[240].
- Białka szoku cieplnego (HSP) – HSP70 i HSP27 są potencjalnymi markerami raka wątrobowokomórkowego[240]. Stwierdzono, że występują odpowiednio w 57% i 62% przypadków choroby[253].
- Glipikan-3 (GPC3) – jest proteoglikanem związanym z błoną komórkową; reguluje wzrost, różnicowanie i migrację komórek[254]. Ekspresja GPC3 jest zwiększona w tkankach nowotworowych w porównaniu z prawidłową wątrobą i jej niezłośliwymi schorzeniami[240].
- GP73 – jest to białko błonowe, jego stężenie jest znacznie podwyższone w gruczolakoraku płuc[255], nasieniaku[256] i raku nerki[257]. GP73 wykazuje ścisłe powiązanie z wieloma patologiami wątroby, jego steżęnie jest znacząco podwyższone w raku wątrobowokomórkowym[258], jednak w marskości wątroby obserwuje się jeszcze wyższe stężenia[259]. Również zakażenie HBV i HCV powodują podwyższenie stężenia GP73. Wykazano, że u pacjentów z rakiem i zakażeniem HBV stężenie markeru jest wyższe niż u nosicieli wirusa[260].
- Glikoproteina towarzysząca nowotworom 72 (CA 72-4, TAG-72) – jest to glikoproteina ulegająca nadekspresji w większości gruczolakoraków, raku żołądka, trzustki i jelita grubego; zwiększona ekspresja TAG-72 towarzyszy również rakowi wątrobowokomórkowemu. Jest potencjalnym markerem prognostycznym, jej nadekspresja jest skojarzona ze złym rokowaniem[261]. Przeciwciało monoklonalne skierowane przeciw tej glikoproteinie może być wykorzystane w diagnostyce[262].
- Alfa-2 glikoproteina cynkowa (ZAG) – jest to glikoproteina ulegająca nadekspresji w raku wątrobowokomórkowym, jest potencjalnym markerem wczesnego raka[240].
Wczesne wykrywanie

W 40% przypadków nowotwór przez długi czas przebiega bezobjawowo, a jednocześnie prawie 90% przypadków raka rozwija się na tle przewlekłej choroby wątroby[263]. Dzięki nowoczesnym metodom diagnozowania i wprowadzeniu systematycznej kontroli pacjentów z marskością wątroby rak coraz częściej jest rozpoznawany w stadium bezobjawowym. Wczesna diagnoza raka wątrobowokomórkowego jest możliwa w 30–60% przypadków[2] (w Japonii guzy poniżej 2 cm stanowią już do 30% przypadków[20]).
Europejskie Towarzystwo Badania Wątroby (EASL, European Association for the Study of Liver) i Amerykańskie Towarzystwo Badań Chorób Wątroby (AASLD, American Association for the Study of Liver Diseases) zalecają regularne badania USG co 6 miesięcy u wszystkich pacjentów z marskością wątroby w stopniu A i B skali Childa-Pugha[f][1][2]. Nie zaleca się rutynowego badania stężeń AFP u pacjentów z grupy nadzoru.
USG jest najbardziej odpowiednim badaniem przesiewowym u pacjentów w grupie ryzyka. Charakteryzuje się czułością 60–90% i specyficznością blisko 90%, badanie jest mniej skuteczne w wykrywaniu wczesnych postaci (czułość 63%)[245]. Wykazano przewagę badania przesiewowego przeprowadzanego co 6 miesięcy nad badaniem przeprowadzanym co 12 miesięcy[245]. Jego efektywność jest mocno zależna od umiejętności operatora i jakości urządzenia.
Badanie przesiewowe za pomocą TK czy MRI nie jest uzasadnione, ze względu na wysoki odsetek wyników fałszywie dodatnich, ryzyko wielokrotnej ekspozycji na promieniowanie (w przypadku TK) oraz wysokie koszty[2].
Zmiany dysplastyczne powinny być regularnie kontrolowane za pomocą badań obrazowych, ponieważ aż jedna trzecia z nich może rozwinąć cechy złośliwości[264][265].
Leczenie

Wybór metody leczenia raka wątrobowokomórkowego zależny od zaawansowania choroby oraz funkcji wątroby. Do kwalifikacji pacjentów do procedur służy klasyfikacja barcelońska (ang. Barcelona Clinic Liver Cancer, BCLC). W zależności od stopnia zaawansowania stosuje się w terapii różne metody: chirurgiczne – klasyczne i małoinwazyjne – oraz farmakologiczne (sorafenib). Do metod klasycznego leczenia chirurgicznego należą resekcja wątroby oraz przeszczepienie wątroby. Małoinwazyjne techniki zabiegowe obejmują metodę przezcewnikowej chemioembolizacji tętniczej (ang. transcatheter arterial chemoembolisation, TACE) oraz metody ablacyjne, z których najważniejszą rolę pełnią ablacja prądem o częstotliwości fal radiowych (ang. radiofrequency ablation, RFA) i przezskórne wstrzyknięcie etanolu (ang. percutaneous ethanol injection, PEI). W leczeniu ogólnoustrojowym wykorzystuje się sorafenib. Radioterapia pełni rolę w leczeniu objawowym przerzutów. Chemioterapia nie jest zalecana ze względu na małą skuteczność.
| Metoda | Stadium |
| resekcja wątroby | BCLC A-0 |
| przeszczepienie wątroby | BCLC A |
| termoablacja lub wstrzyknięcie etanolu | BCLC A-0 |
| chemioembolizacja lub embolizacja | BCLC B |
| sorafenib | BCLC C |
Leczenie chirurgiczne
Podstawową metodą leczenia raka wątrobowokomórkowego jest leczenie chirurgiczne, którego najważniejszymi metodami są częściowa resekcja wątroby i całkowite jej wycięcie z przeszczepieniem narządu.
Resekcja wątroby
Resekcja wątroby jest leczeniem pierwszego rzutu u pacjentów z pojedynczymi guzami wątroby oraz bardzo dobrze zachowaną funkcją wątroby, którą definiuje się przez prawidłowe stężenie bilirubiny, liczbę płytek >100 000/mm³ i prawidłowe ciśnienie w żyle wrotnej (10 mmHg)[g][2]. W praktyce resekcja wątroby dotyczy pacjentów bez marskości, którzy w Europie i Ameryce Północnej stanowią jedynie 5% pacjentów, ale aż 40% pacjentów w Azji[209].
| Kwalifikacja do resekcji wątroby |
| prawidłowe stężenie bilirubiny |
| brak nadciśnienia wrotnego |
| trombocyty powyżej 100 000/mm³ |
Są to chorzy, którzy mogą tolerować większe resekcje, jednak kandydaci do operacji muszą być bardzo starannie dobrani, aby zredukować ryzyko pooperacyjnej dekompensacji czynności wątroby i niewydolności wątroby, a także zwiększonej śmiertelności. Wymaga to dobrej oceny rezerwy funkcjonalnej wątroby oraz zasięgu guza. Usunięcie prawego płata jest bardziej zagrożone niewydolnością wątroby[209]. Pacjenci nie powinni być kwalifikowani do operacji na podstawie skali Childa-Pugha, ze względu na jej niespójną wartość predykcyjną[h][2][209]. Chorzy w klasie A tej klasyfikacji mogą już mieć znacznie upośledzoną funkcję wątroby, która dyskwalifikuje ich od operacji[209].
Obecnie kwalifikacja odbywa się poprzez stwierdzenie prawidłowego poziomu bilirubiny oraz nieobecności nadciśnienia wrotnego, które może być ocenione poprzez cewnikowanie żyły wrotnej (gradient ciśnienia musi wynosić poniżej 10 mmHg)[266] albo zastępczo poprzez stwierdzenie braku żylaków przełyku lub powiększenia śledziony i występowania trombocytów powyżej 100 000/mm³[267][2]. Liczba płytek jest niezależnym czynnikiem predykcyjnym przeżycia po operacji[268]. Funkcja wątroby może być również oceniana za pomocą zieleni indocyjanowej (ICG); metoda ta jest szczególnie rozpowszechniona w Japonii[2]. W konsekwencji stosowania tych kryteriów tylko 10% guzów można poddać resekcji[2].

Resekcje anatomiczne umiarkowanie zmniejszają ryzyko wczesnej wznowy[269]. Marginesy o szerokości 2 cm zapewniają lepsze przeżycie niż marginesy poniżej 1 cm i są zalecane, gdy przy szerszych marginesach jest możliwe zachowanie odpowiedniej funkcji wątroby[270]. Niektóre ośrodki wykonują resekcję u pacjentów z wieloogniskowym guzem spełniającym kryteria mediolańskie (≤ 3 guzy ≤ 3 cm) lub łagodnym nadciśnienieniem wrotnym u chorych niekwalifikujących się do transplantacji[i][271][2].
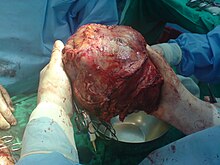
Resekcja jest również metodą leczenia pierwszego rzutu zmian powyżej 5 cm. Za takim postępowaniem przemawia fakt, że bardzo duży pojedynczy guz, który nie nacieka naczyń, sugeruje łagodniejszy charakter zmiany[2].
Śmiertelność okołooperacyjna nie powinna przekraczać 3%[2]; w niektórych ośrodkach raportowano o śmiertelności bliskiej 1%[272]. Nawroty obserwuje się aż u 60–70% chorych poddanych zabiegowi[273][274]. Przeżycie pięcioletnie po resekcji wątroby osiąga 50–60% chorych[209][275][271][276][272].
Leczenie adiuwantowe po resekcji wątroby
Obecnie u pacjentów poddanych resekcji wątroby nie ma wskazań do leczenia adiuwantowego. Żadna z proponowanych terapii nie poprawia wyników leczenia[2].
Najlepiej przebadaną terapią adiuwantową jest leczenie interferonem-α, jednak uzyskane do tej pory dane są sprzeczne. Część badań sugeruje znaczną poprawę wyników leczenia[277][278], inne temu zaprzeczają – dlatego obecnie interferon nie jest zalecanym leczeniem[279].
Adiuwantowa chemioterapia, chemioembolizacja, leczenie lipiodolem (jodowanym olejem z nasion maku) znakowanym 131I (promieniotwórczym izotopem jodu), immunoterapia oraz retinoidy są nieskuteczne jako leczenie adiuwantowe i niezalecane[2].
Transplantacja wątroby
Przeszczepienie wątroby jest cenną metodą leczenia raka wątrobowokomórkowego, szczególnie rozwijającego się na bazie marskości wątroby. Operacja zwykle spełnia kryteria doszczętności onkologicznej i jednocześnie leczy marskość wątroby. Jest podstawową metodą leczenia pacjentów z guzem o wielkości poniżej 5 cm i nielicznych zmian mnogich (maksymalnie trzech).
| Kryteria mediolańskie |
| zmiana mniejsza lub równa 5 cm |
| 3 zmiany mniejsze lub równe 3 cm |
| brak naciekania naczyń |
| brak manifestacji pozawątrobowej raka |
Operacja jest zalecana u pacjentów spełniających kryteria mediolańskie: guz o wielkości do 5 cm lub maksymalnie 3 guzy o wielkości do 3 cm. Rak nie może naciekać naczyń ani przekraczać wątroby[280]. U pacjentów po przeszczepie obserwuje się wysokie – wynoszące 70% – przeżycie pięcioletnie[280][281][282][283] i stosunkowo niewielkie (10–15%) ryzyko nawrotu[284][285]. Przeżycia pięcioletnie poddanych transplantacji u pacjentów z rakiem wątrobowokomórkowym są podobne do obserwowanych u chorych po transplantacji przeprowadzonej z innych przyczyn[286]. Przeszczep w porównaniu do resekcji zapewnia dłuższe przeżycia chorych[222]. Kryteria mediolańskie są niezależnym czynnikiem rokowniczym dla wyników przeszczepienia wątroby[286].
Wadą metody jest niedobór dawców. Brak narządów do przeszczepu powoduje, że w trakcie oczekiwania na operacje ponad 20% oczekujących musi zostać skreślonych z listy oczekujących[287]. Jeśli nie ma dawcy, można rozważyć resekcję[288].
Terapia neoadiuwantowa u kandydatów do przeszczepu
Ze względu na długi okres oczekiwania na przeszczep duże zainteresowanie budzi możliwość terapii neoadiuwantowej, czyli leczenia poprzedzającego zabieg chirurgiczny. Wiele ośrodków stosuje tego typu leczenie, mimo braku randomizowanych badań potwierdzających skuteczność takiego postępowania[2].
Kilka badań bez randomizacji wykazało, że ablacja prądem wysokiej częstotliwości jest skuteczniejsza od chemioembolizacji. Za pomocą ablacji prądem uzyskiwano całkowitą martwicę guza w do 55% przypadków[289], a za pomocą chemioembolizacji do 30%[290][291]. Leczenie może zmniejszać ryzyko skreślenia z listy oczekujących na przeszczep z powodu progresji do stanu niespełniającego kryteriów mediolańskich[289]. Mimo niepełnych danych o skuteczności leczenia neoadiuwantowego u pacjentów oczekujących na przeszczep zaleca się termoablację, a w drugiej kolejności chemioembolizację[2].
Leczenie za pomocą sorafenibu nie jest rekomendowane[2] ze względu na brak odpowiednio dużych badań oraz doniesień o zwiększonym ryzyku powikłań po transplantacji[292]. Wyniki obecnych badań wskazują na korzyści ze stosowania leku jako leczenia adiuwantowego, szczególnie w sytuacji, gdy czas oczekiwania na przeszczep może wynosić więcej niż 6 miesięcy. Niektóre badania wskazują również na korzyści wynikające z leczenia neodiuwantowego, gdy czas oczekiwania na transplantację przekracza 6 miesięcy[293].
Leczenie niechirurgiczne miejscowe

Przeszczepienie wątroby oraz resekcja nie zawsze są możliwe do przeprowadzenia mimo stosunkowo niskiego stopnia zaawansowania. Jeżeli klasyczne leczenie operacyjne jest przeciwwskazane, można zastosować miejscowe postępowanie niechirurgiczne metodami radiologii interwencyjnej. Najczęściej stosowanymi metodami są: termoablacja, krioablacja, przezskórna iniekcja etanolu i chemioembolizacja tętnicza. Takie postępowanie poprawia przeżycie, a w pewnych grupach pacjentów może doprowadzić do wyleczenia[294][295].
Metody ablacyjne
Miejscowe niszczenie guza osiąga się poprzez wstrzyknięcie do guza odpowiednich substancji chemicznych (etanolu, kwasu octowego, rozgrzanego roztworu soli fizjologicznej) lub poprzez uzyskanie odpowiedniej temperatury w guzie (ablacja prądem o częstotliwości radiowej, ablacja mikrofalowa i krioablacja)[296]. Większość zabiegów przeprowadza się przezskórnie, choć czasami jest konieczna operacja laparoskopowa[2].
Ablacja prądem o częstotliwości radiowej (RFA) lub przezskórne wstrzyknięcie etanolu (PEI) jest leczeniem stosowanym u pacjentów we wczesnych stadiach (zaawansowanie 0 lub A według BCLC) nienadających się do zabiegu operacyjnego[j][2][209].
Przezskórne wstrzyknięcie etanolu powoduje koagulację białek, odwodnienie komórek, niedrożność naczyń i w konsekwencji martwicę tkanek. Za pomocą tej metody martwicę guza osiąga się w 90% przypadków nowotworów poniżej 2 cm, w 70% przy guzach o wielkości od 2 do 3 cm i w 50% przy zmianach mierzących od 3 do 5 cm[297][296]. Pięcioletnie przeżycie z marskością w stopniu A wśród chorych leczonych wstrzyknięciami etanolem odnotowuje się w około 50% przypadków[298]. Stosunkowo często (43% leczonych) obserwuje się wznowy miejscowe[299]. Metoda wymaga powtarzania iniekcji. Ze względu na obecność przegród łącznotkankowych wewnątrz guza rzadko osiąga się pełną martwicę dla guzów większych od 3 cm[209].
Ablację prądem o częstotliwości radiowej przeprowadza się poprzez umieszczenie w guzie jednej lub kilku elektrod, następnie za pomocą prądu przemiennego wysokiej częstotliwości (350–500 kHz) dochodzi do wytworzenia energii cieplnej, która powoduje szeroki obszar martwicy guza[300]. Skuteczność tej metody dla guzów poniżej 2 cm jest podobna do wstrzyknięć etanolu, jednak wymaga mniejszej ilości zabiegów[301]. Dla guzów powyżej 2 cm RFA jest skuteczniejszą metodą od iniekcji etanolu[302]. Metoda zapewnia lepszą lokalną kontrolę choroby, co może się przekładać na wzrost przeżycia w porównaniu do iniekcji alkoholu[303][304].Badanie wieloośrodkowe z Włoch sugeruje, że dla guzów mniejszych od 2 cm przeżycie pięcioletnie chorych leczonych RFA jest podobne do resekcji[305]. Wymaga to potwierdzenia w badaniu z randomizacją[209], dlatego obecnie nie można zalecić RFA jako leczenia pierwszego rzutu[2].
Chemioembolizacja
Chemioembolizacja jest zalecaną metodą leczenia u pacjentów w pośrednim stadium zaawansowania (stopień B według BCLC), w przypadku bezobjawowego wieloguzkowego raka bez inwazji naczyń lub rozsiewu pozawątrobowego[k][2]. Metoda nie powinna być przeprowadzana u pacjentów z niewyrównaną marskością wątroby, w zaawansowanym etapie miejscowym i w przypadku rozsiewu pozawątrobowego[l][2].
Guz podczas swojego rozwoju wykazuje intensywną neoangiogenezę. W bardzo wczesnej fazie nowotwór nie jest dobrze ukrwiony, jego zaopatrzenie pochodzi głównie od żyły wrotnej. W miarę postępu choroby unaczynienie raka staje się coraz bardziej zarterializowane, zależne od tętnicy wątrobowej. Stanowi to podstawę diagnostyki radiologicznej oraz metody leczenia opartej na wywoływaniu ostrego zatoru tętniczego i powodowania martwicy guza.
Niedrożność jest uzyskiwana podczas zabiegu embolizacji dotętniczej (ang. transcatheter arterial embolization, TAE) lub w połączeniu z podaniem chemioterapeutyków, rozpuszczonych zwykle w lipiodolu, w zabiegu chemioembolizacji dotętniczej (ang. transcatheter arterial chemoembolization, TACE)[209].
Jako materiału zatorowego używa się gąbki żelatynowej (Gelfoam), alkoholu poliwinylowego[306], mikrosfer ze zmodyfikowanej skrobi[307], metalowych cewek[308] i autologicznych skrzepów krwi[309]. Zabieg wymaga wprowadzenia cewnika do tętnicy wątrobowej i następnie jej gałęzi płatowej i segmentowej, aby uzyskać możliwie selektywny obszar zabiegu.
W metodzie chemioembolizacji dotętniczej wykorzystuje się zdyspergowany w lipiodolu cytostatyk, który jest selektywnie wychwytywany w guzie[209]. Najczęściej stosowanymi cytostatykami są doksorubicyna (adrianomycyna) i cisplatyna[310]. Nie ma dobrych dowodów wskazujących najlepszy środek chemioterapeutyczny[2]. TACE wywołuje częściowe odpowiedzi u 15–60% pacjentów[309][310]; według metaanalizy metoda ta zwiększa również przeżycie chorych[311][209].
Metoda jest przeciwwskazana w przypadku braku przepływu w żyle wrotnej (zakrzepica, zespolenie wrotno-układowe), ze względu na zwiększone ryzyko martwicy niedokrwiennej niezajętej przez proces rozrostowy części wątroby oraz zgonu z powodu niewydolności wątroby. Również chorzy ze schyłkową niewydolnością wątroby (B i C w skali Childa-Pugha) mają zwiększone ryzyko zgonu[312][313][2]. Badane są metody łączące TACE z metodami ablacyjnymi i/lub leczeniem ogólnoustrojowym[2].
Radioterapia
Tolerancja wątroby na promieniowanie jest stosunkowo niska (maksymalna dawka tolerowana wynosi 30 Gy)[1], co utrudnia stosowanie konwencjonalnych terapii zewnętrzną wiązką promieniowania, mimo że rak wątrobowokomórkowy jest faktycznie promieniowrażliwy[314]. Choć jest możliwe ogniskowe wysokodawkowe napromieniowanie wątroby, nie ma dowodów naukowych, by stosować taką terapię w leczeniu raka wątrobowokomórkowego[315][2]. Radioterapia wiązkami zewnętrznymi (EBRT) może mieć znaczenie w przypadkach nienadających się do leczenia miejscowego lub opornych na tego typu leczenie[315][2].
Radioterapia paliatywna może być stosowana do złagodzenia bólu związanego z przerzutami do kości[316][317], również w przypadku przerzutów do mózgu[315], płuc[318] i węzłów chłonnych[315].
Radioembolizacja

Jest to metoda wysoko selektywnej brachyterapii opartej na podawaniu mikrosfer z radioaktywnymi izotopami, takimi jak lipiodol znakowany131I[319] czy mikrosfer zawierających 90Y[320][321][322], bezpośrednio do tętnicy wątrobowej[323]. Ze względu na wzmożone unaczynienie guza terapeutyki są dystrybuowane do obszaru guza, gdzie selektywnie emitują promieniowanie. Metoda różni się od TACE, w której efekt terapeutyczny jest zależny od uzyskania niedokrwienia guza, osiągany za pomocą okluzji naczyń o średnim i dużym kalibrze. Podawanie leku ma za zadanie zwiększenia efektu niedokrwienia[324]. W radioembolizacji stosuje się mniejsze cząstki, które mają za zadanie dostarczyć radiofarmaceutyk bezpośrednio do guza, a efekt terapeutyczny jest uzyskiwany głównie przez promieniowanie[323]. Efekt zatorowy jest minimalny, dlatego mikrosfery zawierające 90Y mogą być stosowane w przypadku zakrzepicy żyły wrotnej[322]. Odsetek odpowiedzi obiektywnych waha się w zakresie od 35–50%[322][320][325].Obecnie nie ma randomizowanych badań porównujących radioembolizację z chemioembolizacją czy sorafenibem zarówno w stadium pośrednim, jak i zaawansowanym. Radioembolizacja za pomocą 131I lub 90Y nie jest zalecana jako standardowa terapia[m][2][209].
Klasyczna chemioterapia
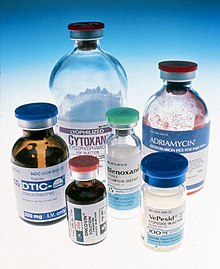
Chemioterapia ogólnoustrojowa nie jest użyteczną metodą w praktyce klinicznej i nie rekomenduje się jej stosowania w leczeniu raka wątrobowokomórkowego[2][209][1]. Nieskuteczność tej metody leczenia wynika z oporności nowotworu na stosowane leki spowodowanej częstą obecnością genu oporności wielolekowej MDR[326][327]. Dodatkowo marskość zaburza metabolizm leków, zwiększając ich toksyczność[328]. Najbardziej skutecznym lekiem jest doksorubicyna (adrianomycyna)[1], która w monoterapii charakteryzuje się odsetkiem obiektywnych odpowiedzi około 5–30%[328][329]. Jednak ma niewielki wpływ na przedłużenie przeżycia, które lek wydłuża o około 3 miesiące[328]. Schematy wielolekowe PIAF[330] (cisplatyna, doksorubicyna, fluorouracyl i interferon) oraz ECF (etopozyd, cisplatyna i fluorouracyl)[328] nie wykazały przewagi nad doksorubicyną.
Leczenie celowane
Sorafenib
Rak wątrobowokomórkowy jest uważany za nowotwór chemiooporny. Do 2007 roku w zaawansowanym stadium nie zalecano żadnego leczenia ogólnoustrojowego[331]. Sytuację zmieniło wprowadzenie do leczenia sorafenibu.
Sorafenib jest doustnym inhibitorem angiogenezy, działa poprzez blokadę licznych kinaz – grupy białek biorących udział w regulacji licznych procesów biochemicznych. Lek jest aktywny wobec kinazy Raf[332], receptora PDGF-β (PDGFR-β), receptorów VEGF, kinazy tyrozynowej podobnej do białka FMS (kinazy FLT-3) oraz białka C-KIT, C-RAF, B-RAF i kinazy tyrozynowej RET[333][332]. Lek wydłuża przeżycie u chorych na raka wątrobowokomórkowego[331][334]. W randomizowanym badaniu klinicznym wykazano, że przeżycie całkowite leczonych sorafenibem wynosiło 10,7 miesięcy, podczas gdy leczonych wyłącznie placebo wynosiło 7,9 miesięcy[331]. Wydłuża również czas do progresji (TTP)[331]. Lek jest dość dobrze tolerowany. Konieczność odstawienia z powodu działań niepożądanych wystąpiła u 15% leczonych (w porównaniu do 7% u chorych leczonych placebo)[2].
Lek jest standardową terapią u pacjentów z zaawansowanym rakiem wątrobowokomórkowym (zaawansowanie C według BCLC) u pacjentów z dobrze zachowaną czynnością wątroby (klasa A Childa-Pugha)[k][2][209]. Rola leku u pacjentów z marskością w klasie B Childa-Pugha nie jest jasna. Niektóre badania sugerują, że lek w tym zaawansowaniu niewydolności wątroby ma podobne działanie przeciwnowotworowe i profil bezpieczeństwa do klasy A[209]. Nie ma leków drugiego rzutu dla chorych nietolerujących sorafenibu lub w przypadku jego nieskuteczności[2]. Sorafenib jest testowany jako leczenie adiuwantowe u pacjentów poddanych resekcji lub metodom ablacyjnym we wczesnym stadium w połączeniu z chemioembolizacją w zaawansowaniu pośrednim, w kombinacji z erlotynibem, z doksorubicyną oraz jako samodzielny lek w marskości o stopniu B w skali Childa-Pugha[335][2].
Badane leki celowane
- Bewacyzumab – jest to humanizowane przeciwciało monoklonalne, które wiąże izoformy VEGF-A. Lek w monoterapii wykazywał aktywność, podczas jego stosowania u 10% leczonych występowała obiektywna odpowiedź, a mediana przeżycia wolnego od progresji choroby (PFS) wynosiła 7 miesięcy[336]. Bawacizumab oceniano również w połączeniu z chemioterapią. Lek w skojarzeniu z gemcytabiną i oksaliplatyną wywołuje odpowiedź obiektywną do 20% leczonych, mediana przeżycia całkowitego (OS) wynosi około 10 miesięcy[337]. Obecnie nie ma badań III fazy potwierdzających te wyniki.
- Sunitynib – jest inhibitorem angiogenezy, działa poprzez selektywne blokowanie receptora PDGF, receptora VEGF, białka C-KIT, FLT-3[338]. Lek może potencjalnie być aktywny w leczeniu raka wątrobowokomórkowego, jednak nie może być stosowany w leczeniu tej choroby ze względu na występowania ciężkich działań niepożądanych i zgonów z powodu ciężkiej niewydolności wątroby u około 5–10% leczonych[339][340][341].
- Inhibitory mTOR – jest to grupa leków blokująca kinazę białkową treoninowo-serynową mTOR, która reguluje wzrost, proliferację, procesy translacji i transkrypcji[342]. Jako potencjalny lek drugiego rzutu był badany ewerolimus, jednak wykazano, że ten lek nie zwiększa przeżycia całkowitego[343].
- Inhibitory EGFR – jest to grupa leków blokująca receptor naskórkowego czynnika wzrostu (EGF). Badano erlotynib, gefitynib, cetuksymab, lapatynib i wandetanib. Erlotynib w badaniu II fazy wykazywał aktywność[344], lek nie wykazał skuteczności w połączeniu z sorafenibem[345]. Gefitynib i lapatynib[346] nie wykazały większej skuteczności. Pozostałe leki są w trakcie badań[2].
Ocena zaawansowania oraz rokowania
Ocena zaawansowania ma na celu wybór najlepszego sposobu leczenia oraz ustalenia rokowania. W przypadku raka wątrobowokomórkowego występuje dość specyficzna sytuacja, w której poza chorobą nowotworową zwykle współistnieje marskość wątroby. Oba stany są zagrożeniem życia chorych, dlatego ocena zaawansowania choroby nowotworowej nie może być rozpatrywana w oderwaniu od oceny funkcji metabolicznej wątroby.
Ocena zaawansowania choroby musi uwzględniać trzy aspekty: ocenę zaawansowania procesu rozrostowego, ocenę funkcji wątroby i ocenę stanu ogólnego (skala ECOG).
Istnieje kilka kompleksowych systemów oceny zaawansowania, najważniejsze to klasyfikacja barcelońska[n] (BCLC, ang. Barcelona Clinic Liver Cancer)[18], klasyfikacja francuska[347], CLIP (ang. Cancer of the Liver Italian Program)[348], CUPI (ang. Chinese University Prognostic Index)[349], JIS (ang. Japan Integrated Staging)[350]. Największe znaczenie ma klasyfikacja barcelońska i jest zalecaną klasyfikacją do oceny zaawansowania choroby[2][209].
Klasyfikacja zawiera czynniki prognostyczne oceniające guz, wydolność wątroby i stan ogólny w oparciu o randomizowane badania[351][352].
Klasyfikacja barcelońska
Jest to zalecany system oceny zaawansowania choroby. Klasyfikacja dzieli pacjentów na pięć grup (0, A, B, C i D), co ma kluczowe znaczenie w kwalifikacji chorych do konkretnych metod leczenia.
Obejmuje cechy guza (wielkość zmiany, liczba ognisk, obecność inwazji naczyniowej, zajęcie regionalnych węzłów chłonnych i obecność przerzutów), funkcje wątroby (klasyfikacja Childa-Pugha) i stan ogólny (klasyfikacja ECOG). Uwzględnia również parametry ważne do kwalifikacji zabiegów (poziom bilirubiny, nadciśnienie wrotne), które również mają wpływ na rokowanie.
| Stopień | Skala ECOG | Cechy guza | Funkcja wątroby | Opcje terapeutyczne |
| 0 | 0 | pojedynczy <2 cm | dobra | resekcja, RFA, przeszczep |
| A1 | 0 | pojedynczy <5 cm | bez nadciśnienia wrotnego | resekcja, RFA, przeszczep |
| A2 | 0 | pojedynczy <5 cm | nadciśnienie wrotne, bilirubina w normie | resekcja, RFA, przeszczep |
| A3 | 0 | pojedynczy <5 cm | nadciśnienie wrotne, bilirubina powyżej normy | RFA, przeszczep |
| A4 | 0 | <3 guzy <3 cm | nie ma zastosowania | przeszczep, TACE |
| B | 0 | duży wieloguzkowy | A lub B w skali Childa-Pugha | TACE |
| C | 1–2 | inwazja naczyniowa lub przerzuty | A lub B w skali Childa-Pugha | sorafenib |
| D | 3–4 | każdy | C lub D w skali Childa-Pugha | terapia paliatywna |
Stadium 0 – bardzo wczesne (BCLC 0)
Jest to obecność pojedynczego guza o średnicy poniżej 2 cm, bez inwazji naczyń, bez zmian satelitarnych, u pacjentów w dobrym stanie ogólnym (ECOG 0) i dobrze zachowaną czynnością wątroby (klasa A w skali Childa-Pugha). W tym stadium chorobę rozpoznaje się u około 5–10% pacjentów[2].
Przeżycie 5-letnie osiąga 80–90% pacjentów leczonych za pomocą transplantacji lub resekcji wątroby[353][354] oraz 70% pacjentów leczonych RFA[305][354].
Stadium A – wczesne (BCLC A)
Jest to obecność pojedynczego guza o średnicy 2–5 cm lub 3 guzków o średnicy do 3 cm u pacjentów w dobrym stanie ogólnym (ECOG 0) i czynnością wątroby w klasie A lub B skali Childa-Pugha[2].
Przeżycie 5-letnie osiąga 50–70% pacjentów po przeprowadzonej transplantacji, resekcji wątroby lub RFA[354][20].
Stadium B – pośrednie (BCLC B)
Jest to obecność zmiany wieloguzkowej (więcej niż 3 guzki) u pacjentów w dobrym stanie ogólnym (ECOG 0)[2].
Przeżycie 2-letnie pacjentów nieleczonych[o] osiąga 8–50% pacjentów[311][20], mediana przeżycia wynosi 16 miesięcy[2]. Pacjenci leczeni za pomocą TACE osiągają medianę przeżycia 19–20 miesięcy[311][2]. Chorzy najlepiej odpowiadający na leczenie TACE mogą osiągać medianę przeżycia 36–45 miesięcy[355][356].
Stadium C – zaawansowane (BCLC C)
Jest to stadium objawowej choroby nowotworowej u pacjentów w stanie ogólnym ECOG 1 lub 2, w którym rozpoznaje się inwazję dużych naczyń (wrotną lub segmentową) lub zajęcie węzłów chłonnych lub obecność przerzutów. Czynność wątroby w tej grupie jest w klasie A lub B skali Childa-Pugha[2].
Nieleczeni osiągają medianę przeżycia o wartości około 6 miesięcy[20]. Długość przeżycia może się różnić w zależności od czynności wątroby[20]. U chorych leczonych sorafenibem mediana przeżycia wynosi 9,5 miesiąca[357].
Stadium D – końcowe (BCLC D)
Jest to stadium u pacjentów w złym stanie ogólnym (ECOG > 2) lub o złej funkcji wątroby (klasa C w skali Childa-Pugha)[2].
W tym stadium mediana przeżycia wynosi od 3 do 4 miesięcy[20], 11% chorych osiąga jednoroczne przeżycie[357].
Klasyfikacja TNM
Stosowana powszechnie w onkologii klasyfikacja TNM w raku wątrobowokomórkowym ma mniejsze znaczenie, ponieważ nie ocenia rezerwy czynnościowej wątroby ani stanu ogólnego pacjenta. Obecnie obowiązuje klasyfikacja TNM z 2009 roku.
| T | Opis |
| TX | Nie można ocenić guza pierwotnego |
| T0 | Nie stwierdza się guza pierwotnego |
| T1 | Pojedynczy guz nie naciekający naczyń |
| T2 | Pojedynczy guz z naciekaniem naczyń lub guzy mnogie ≤5 cm |
| T3 | Guzy mnogie >5 cm lub naciekanie głównego odgałęzienia żyły wrotnej lub wątrobowej |
| T4 | Guz pojedynczy lub guzy mnogie z bezpośrednim naciekaniem innych narządów innych niż pęcherzyk żółciowy lub przechodzenie poza otrzewną trzewną |
| N | Opis |
| Nx | Nie można ocenić okolicznych węzłów chłonnych |
| N0 | Nie stwierdza się przerzutów w okolicznych węzłach chłonnych |
| N1 | Obecność przerzutów w węźle chłonnym |
| M | Opis |
| MX | Nie można określić obecności przerzutów odległych |
| M0 | Nie stwierdza się przerzutów odległych |
| M1 | Przerzuty odległe obecne |
| stopień | T | N | M |
| I | T1 | N0 | M0 |
| II | T2 | N0 | M0 |
| IIIA | T3 | N0 | M0 |
| IIIB | T4 | N0 | M0 |
| IIIC | T1, T2, T3, T4 | N1 | M0 |
| IV | T1, T2, T3, T4 | N0, N1 | M1 |
Rokowanie
| Stadium | Przeżycie (miesiące) |
| BCLC A | >60 |
| BCLC B | 20 (45-14) |
| BCLC C | 11 (6-14) |
| BCLC D | <3 |
Uwagi
Przypisy
Bibliografia
- Radzisław Kordek (red.): Onkologia. Podręcznik dla studentów i lekarzy. Gdańsk: VIA MEDICA, 2007. ISBN 978-83-7555-016-0.
