Jon hydroniowy
Jon hydroniowy (jon hydronowy) − najprostszy jon oksoniowy. Jest to uwodniony kation wodorowy H3O+[1][2].
| |||||||||||||
 Powierzchnia potencjału elektrycznego | |||||||||||||
| |||||||||||||
| Ogólne informacje | |||||||||||||
| Wzór sumaryczny | H3O+ | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa | 19,02 g/mol | ||||||||||||
| Identyfikacja | |||||||||||||
| Numer CAS | |||||||||||||
| PubChem | |||||||||||||
| |||||||||||||
| |||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||
W roztworach wodnych powstaje w wyniku autodysocjacji wody: 2H2O ⇌ H3O+ + OH−oraz w wyniku dysocjacji kwasów, następnie ulega dalszej hydratacji. Występuje również w kryształach monohydratów mocnych kwasów (np. kwasu nadchlorowego) i superkwasów.
Jest silnym kwasem Lewisa, jego pKa = −1,7 (w 25 °C). W czystej wodzie jego stężenie wynosi 10−7mol/dm³ (25 °C), w roztworach kwasowych jest większe. Stężenie (a ściślej aktywność) jonu hydroniowego określa pH roztworów wodnych.
Literatura chemiczna używa również wyrażeń kation wodorowy oraz proton jako (w uproszczeniu) synonimów H3O+, chociaż terminy te mają odrębne znaczenia w innych kontekstach.
Struktura
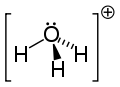
Grupa H3O+ jest izoelektronowa z amoniakiem ponieważ atom O oraz N mają taką samą liczbę elektronów. H3O+ ma geometrię piramidy o podstawie trójkąta z atomem tlenu na jednym z wierzchołków. Wiązania H−O−H tworzą kąt około 113°. Centrum masy znajduje się blisko jądra atomu tlenu. Grupa ta jest polarna (tzn. ma elektryczny moment dipolowy).
Solwatacja
W roztworze wodnym grupa ta jest solwatowana przez molekuły wody, tworząc m.in. kation Zundela H5O+2 i kation Eigena H9O+4. Pomiary kriometryczne wskazują, że hydratowany jon ma przeciętnie wielkość odpowiadającą H3O+(H2O)6[3]. Metody ab initio w chemii kwantowej wskazują, że hydratowany proton przebywa na powierzchni klasterów wody odpowiadających średnio formule H3O+(H2O)20.