원자가 껍질 전자쌍 반발 이론
원자가껍질 전자쌍 반발 이론(Valence shell electron pair repulsion theory : VSEPR theory)이란 화학에서 중심원자의 배위수와 전자쌍 반발 원리를 통해 분자의 구조를 예측, 나타내는 모형이다.[1](루이스 구조식에서 비공유 전자쌍을 나타내주어야 한다)

이 이론은 루이스 구조에서 나타나는 중심원자의 각 전자쌍들은 서로 반발하므로 서로 가장 멀리 떨어진 위치에 존재하게 된다는 것에 기초하여 분자의 구조를 나타낸다. 예를 들어 중심원자에 3개의 전자쌍이 존재한다면 각 전자쌍은 중심원자를 중심으로 정삼각형의 형태로 위치하게 되는 것이다. 분자를 구성하는 원자들은 결합전자쌍을 통해 결합하고 있으므로 결합전자쌍의 배치가 곧 분자의 모양이 된다.
전자쌍에는 결합전자쌍과 비공유전자쌍(비결합전자쌍)이 있는데 결합전자쌍보다 비공유전자쌍의 반발력이 더 크다. 따라서 비공유-비공유 전자쌍 간의 반발력이 가장 크며 결합-결합 전자쌍 간의 반발력이 가장 작다. 따라서 같은 개수의 전자쌍을 갖고 있더라도 결합전자쌍과 비공유전자쌍의 구성에 따라 각 전자쌍들이 이루는 각은 조금씩 달라질 수 있다.
역사
1940년 분자기하학과 원자가전자 사이의 관계에 대한 첫번째 모델이 제기되었으며,[2] 1957년 로널드 길레스피와 로널드 시드니 니홈에 의해 더 발전하였다.[3][4]
입체수와 비결합전자쌍 수에 따른 분자의 모양
입체수(Steric Number, 결합수 + 비결합전자쌍의 수)와 비결합전자쌍의 수에 따른 분자의 모양은 다음과 같다.
| 입체수 | 분자기하 [5] 비공유전자쌍 없음 | 분자기하 [6]:413–414비공유전자쌍 | 분자기하 비공유전자쌍 4개 | |
|---|---|---|---|---|
| 2 |  | |||
| 3 |  |  | ||
| 4 |  |  |  | |
| 5 |  | 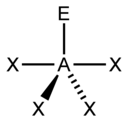 |  |  3) |
| 6 | 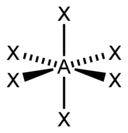 |  |  | |
| 7 |  | 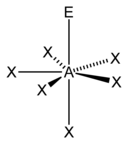 5)[8] | 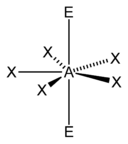 5)[9]:498 | |
| 8 |  (TaF3− | |||
| 9 | 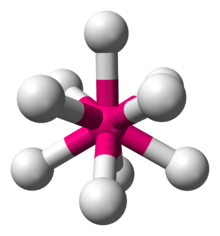 세모자쓴 삼각기둥형 (ReH2− 세모자쓴 삼각기둥형 (ReH2−9)[9]:254 |