全身性エリテマトーデス
全身性エリテマトーデス(ぜんしんせいエリテマトーデス、英語: systemic lupus erythematosus; SLE, ドイツ語: lupus erythematodes)とは、なんらかの原因によって種々の自己抗体を産生し、それによる全身性の炎症性臓器障害を起こす自己免疫疾患[1]で膠原病の一つ。全身性紅斑性狼瘡(ぜんしんせいこうはんせいろうそう)、単に狼瘡(ろうそう)とも呼ばれる。産生される自己抗体の中でも、抗DNA抗体は特異的とされる[1]。特定疾患(難病)に指定されている。動脈硬化性心血管病による死亡率および罹病率も高い[2]。
| 全身性エリテマトーデス | |
|---|---|
 | |
| 狼瘡における両側頬部にわたる蝶形紅斑 | |
| 概要 | |
| 診療科 | 免疫学, リウマチ学, 皮膚科学 |
| 分類および外部参照情報 | |
| ICD-10 | L93, M32 |
| ICD-9-CM | 710.0 |
| OMIM | 152700 |
| DiseasesDB | 12782 |
| MedlinePlus | 000435 |
| eMedicine | med/2228 emerg/564 |
| Patient UK | 全身性エリテマトーデス |
| MeSH | D008180 |
語源
全身性は文字通り体中どこにでも症状が起こること、エリテマトーデスは紅斑(エリテマ)症をそれぞれ意味し、本疾患に特徴的に生じる皮疹に由来する。英語の病名中にある lupus はラテン語で狼の意であり、「狼に噛まれたような」と称されるSLEの皮膚症状より名づけられたものであるが、日本語と中国語で狼瘡と呼ばれる事がある。lupus の語は「CNSループス」「ループス腎炎」などで見られる。
疫学
男女比は女性9に対して男性が1である[3]。また発症年齢は出産適齢期と重なる20~40歳が好発であるため[4]、エストロゲンなどの女性ホルモンの関与を示唆する報告がある[5][6]。男性は女性より治療抵抗性で、必要とされるステロイド投与量が多かったり、中枢神経症状や腎症が多いなど、重症化しやすいという報告もある[7]。膠原病の中では、関節リウマチに次いで2番目の頻度で見られる疾患である(ただし、シェーグレン症候群の軽症も含めた患者数は十分把握されておらず、実際にはそれより少ないと考えられる)。日本のSLE患者数は、約6~10万人と推定される[3]。
病因
全身性エリテマトーデス(SLE)症例の10%以上が薬剤誘発性であると推定されている[8]。直接的な要因は未解明であるが、ウイルス感染、内分泌異常、遺伝因子、人種などが複雑に関与するとされている[7][9]。
遺伝因子
双生児研究によると、一卵性双生児では25%の疾患一致率を認めるが[5]、二卵性双生児では10%に満たない。これはSLEの発症における遺伝因子の強い影響力を意味していると捉えられる。古典的遺伝マーカーとして、HLA-DRB1*1501が全人種で関連を認められている(HLA-DRB1*0301は白人で強い関連を認めるが、他人種では認められない)。ゲノムワイド連鎖解析がこれまで11件行われているが、互いに指し示された領域が異なっていて明確な結論は得られない。それらのメタアナリシスによれば1、6、11番染色体上に疾患感受性遺伝子が存在する可能性がある。
ヒトゲノム上のほぼ全ての一塩基多型 (SNP)を網羅する研究において、HLA領域のほか、IRF5、ITGAM、KIAA1542、PXK、FCGR2A、PTPN22、STAT4各遺伝子[10]やBLK[11]、TNFAIP3[12]上に信頼性の高い関連が報告された。これらのうち少なくともIRF5、STAT4、BLK、TNFAIP3などについてはアジア人においてもSLEの発症と関連するほか、アジア人において特有に認められた危険因子も報告されている[13]。また、これらのうちSTAT4などはSLEのみならず関節リウマチなど複数の自己免疫性疾患と関連していることが報告されてきている。今後は具体的にSLEを引き起こす過程の分子生物学的な研究、後述する多様な病態それぞれとの関連の解明、さらには治療法の開発が待たれている。
環境因子
強い日光への暴露後にSLEを発症したりSLE病勢の増悪が見られる事から紫外線、喫煙、過去のウイルス感染が関与していると考えられている[9][14]。SLEとの関わりが最も良く知られているウイルスは、人間の9割が感染しているヘルペスウイルスの一種、エプスタイン・バール・ウイルス(EBウイルス)である[15][16][17][18][19][20][21][22][23][24][25][26][27]。特に、EBウイルスの潜伏感染遺伝子抗原のEBNA1(Epstein-Barr virus-encoded nuclear antigen 1)とSLEの自己抗原とされているSmとの分子相同性(molecular mimicry)も明らかになっており、EBNA1に対して作られた抗体が自己抗原のSmに交叉反応(クロスリアクション)し、SLEの自己抗体の抗Sm抗体となっていることも示唆されている[28][29][30]。このEBウイルスは以下の「最新の知見」に述べる様に、あらゆる自己抗体の産生に寄与し、SLEを含む様々な自己免疫疾患の成立に大きな役目を果たしているウイルスである。
最新の知見
最新の知見によると、ゲノムのうちの遺伝子以外の部分は遺伝子のスイッチのON・OFFに関与していると判明した。その部分が異常を起こすと、自己免疫系の疾患になることがある。一見無関係ないくつかの病気は、調節回路を共有していることがわかった。すなわち慢性関節リウマチ、1型糖尿病、狼瘡およびその他の自己免疫疾患がそれだ。この事実は、ひとつの薬がそれらすべてに有効である可能性を示唆している[31]。また、大阪大学微生物病研究所/免疫学フロンティア研究センターらの研究グループは2015年、SLEや多発性硬化症といった自己免疫疾患との関わりが知られているEBウイルスによる自己免疫疾患発症のメカニズムを分子生物学的に示した[32][33][34]。
通常、胚中心B細胞(成熟段階にあるB細胞)の表面に、排除する抗原に合わないB細胞受容体や、自分の抗原に反応するB細胞受容体があれば、そのB細胞はアポトーシスにより排除される。しかし、その胚中心B細胞がEBウイルスに感染すると、EBウイルスの潜伏感染Ⅲ型遺伝子のLMP2AがB細胞受容体シグナルを模倣し、さらに形質細胞(抗体産生細胞)への分化を促進する因子(Zbtb20)が出現して、本来はアポトーシスにより排除されるべき自己反応性B細胞が生き残り(B細胞選択異常)、自己反応性受容体などの抗体を出し続ける形質細胞になる結果、自己免疫疾患が発症するということである[32]。
診断と分類
通常アメリカリウマチ学会の診断基準(1982年[35]および 1997年改定[36])に従って診断する。感度、特異度とも90%をこえる診断基準である。また、特定疾患の申請においても本診断基準が採用されている。2012年に改定された[37]。
| 項目 | 主要所見 | 解説 |
|---|---|---|
| 1. | 頬部紅斑 Malar rash | 鼻梁から鼻唇溝へ広がる紅斑、 平坦なことも隆起していることもある |
| 2. | 円板状皮疹 Discoid rash | 円板状エリテマトーデス, 感度8.4~19.7%、特異度93.6~99%[38] |
| 3. | 日光過敏 Photosensitivity | 日光に対する過敏な反応による皮疹 |
| 4. | 口腔潰瘍 Oral ulcers | 口腔、鼻咽頭の潰瘍、通常無痛性. 感度27~44.2%、特異度92.1~96%[38] |
| 5. | 関節炎 Arthritis | 2ヵ所以上の末梢性の非破壊性関節炎で、 痛み・腫れ・関節液貯留を伴う |
| 6. | 漿膜炎 Serositis | 次のいずれか: 胸膜炎-胸痛・胸膜摩擦音・胸水、 心膜炎-心電図・心膜摩擦音・心のう水 |
| 7. | 腎障害 Renal disorder | 次のいずれか: 尿蛋白-0.5g/日以上または3+以上、 細胞性円柱 |
| 8. | 神経障害 Neurologic disorder | 次のいずれか: 痙攣、精神症状(薬剤、尿毒症、ケトアシドーシス、電解質異常を除く) 精神症状 |
| 9. | 血算異常 Hematologic disorder | 次のいずれか: 溶血性貧血、白血球減少(<4000/mm3, 感度46~48%、特異度95.9~99%[38])、 リンパ球減少(<1500/mm3)、血小板減少(<100,000/mm3) |
| 10. | 免疫異常 Immunologic disorder | 次のいずれか: 抗DNA抗体、抗Sm抗体、抗リン脂質抗体抗DNA抗体、 抗Sm抗体、抗リン脂質抗体 |
| 11. | 抗核抗体 Antinuclear antibody | 抗核抗体の陽性(薬剤によるものを除外)感度99.5%、特異度19.4%[38] |
- 上記4項目以上でSLEと診断する。(出現時期は一致しなくともよい)
出典:大阪大学 免疫アレルギー内科の資料[9]を引用し改変。
経過
ステロイド薬が一般化する前(1950年頃まで)は、患者の多くは病状が急激に進行し、合併症で5年以内に死亡していた。しかしステロイドや免疫抑制剤が治療に使われるようになると、90 %以上の患者が長期の寛解が得られるようになった。
症状
全身症状
- 発熱
- 易疲労感
- 体重減少
- 多臓器病変
部分症状
- 皮膚・粘膜症状
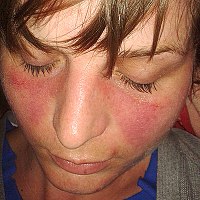
- 蝶形紅斑(バタフライ・ラッシュ)
- 多形滲出性紅斑
- ディスコイド疹、亜急性皮膚エリテマトーデス(SCLE)、lupus profundusなど
- レイノー症状
- 本症の25%に見られる。
- 光線過敏症
- 本症の大半で見られ、しばしば初回の診察のきっかけとなる。男性に多い[7]。
- 口腔潰瘍
- 無痛性の口内炎
- 脱毛
- 筋肉・関節症状
- 関節炎・関節痛
- 対称性。なお、ジャクー関節症と呼ばれる可逆性の関節変形をきたすことはあるが、関節リウマチと異なり関節破壊は起こさない。
- 筋肉
- 腎症状
- ループス腎炎。腎不全の原因となりえるため治療法が存在しなかった時代には最大の死因であった。タンパク尿や浮腫(むくみ)など症状があり、ネフローゼ症候群に発展することもある。血尿からはじまることはまれである。他の腎疾患(膜性増殖性糸球体腎炎、膜性腎症など)の病像を呈する上、その疾患経過は予測不能である。分類法として世界的にWHO分類が用いられている。現在では透析療法によって、死亡の原因となることはない。
- 神経症状
- CNSループス(central nervous system lupus)
- うつ症状は自殺の原因となりうるので重要であるが、治療薬であるステロイドの副作用としても起きうる。さらには慢性の疾患である本症にかかっているという事実そのものが、人体の正常な反応としてうつ症状をおこすことも多い。
- 痙攣は、細菌性髄膜炎などによる可能性がある(本症では免疫能が低下していて感染症にかかりやすい)ほか、抗リン脂質抗体症候群による脳梗塞後遺症としても起きうる。
- 血管炎を反映した多発単神経炎がおきうるほか、急性炎症性多発性根神経炎としてギラン・バレー症候群のような症状を呈することもある。横断性脊髄炎も有名な症状であるが抗リン脂質抗体症候群と関連した病態である。
- 心血管症状
- 漿膜炎としての心外膜炎や、リーブマン・サックス心内膜炎、心筋炎を発症することがある。心外膜炎は、重症であれば心タンポナーデの原因となる。
- 近年は、ステロイドの副作用の影響を除外してもなお、本症そのものが虚血性心疾患の増悪因子であることが明らかとなっている。
- 肺症状
- 漿膜炎のひとつとしての胸膜炎は頻度が高い。いっぽう、通常自己免疫疾患にみられやすい間質性肺炎や肺高血圧の頻度はあまり高くない。むしろ起こりやすいのはニューモシスチス肺炎やサイトメガロウイルス肺炎である。びまん性肺胞出血を伴う急性ループス肺炎がおきることがある。抗リン脂質抗体症候群に基づく肺血栓塞栓症も起こる。
- 消化管症状
- 悪心、嘔吐、便秘、下痢、腹痛などが起きうる。原因としてはタンパク漏出性腸症、腸間膜血管炎などがありループス腸炎と称される腸の非特異的炎症もおこりうるがまれとされる。それらの腸症状の原因はときにループス膀胱炎であることがある。結核性腸炎やサイトメガロウイルス性腸炎との鑑別が必要。
- 血液症状
- 汎血球減少(血小板・赤血球・白血球の減少)。そのため、易感染や易出血性、全身に出血斑が生じたり、貧血の原因となったりする。凝固能異常は通常抗リン脂質抗体症候群または血小板減少(この症状のみが先行する時は、特発性血小板減少性紫斑病(idiopathic thrombocytopenic purpra: ITP)と診断される事がある)が原因で、血液がかたまりやすくなる(そのため肺血栓塞栓症、脳梗塞などの原因となる)ほか、抗リン脂質抗体症候群は習慣性流産の原因となる。赤血球減少(貧血)は溶血性貧血であり、自己免疫性溶血性貧血(autoimmune hemolytic anemia: AIHA)と呼ばれる。ITPとAIHAの合併する状態をエヴァンズ症候群と呼ぶが、実は本疾患の先行症状である事が多い。
- 脳血管障害による症状
- 視神経が傷害され急に失明することもある。初期症状は不眠や集中力低下とも言われるが多彩で一言で言い切れるものではない。急性の経過、慢性の経過、ありとあらゆることが起きうる。ループス頭痛(lupus headache)と呼ばれる頭痛も起こす。
- 肝臓、膵臓
- 特にルポイド肝炎とよばれる慢性肝炎がおきるが、本疾患に特徴的な病理学的変化があるわけではない。本症そのものによる症状であるのかどうかについて疑問を呈する向きもあるが、本症発症時には脂肪肝や原発性胆汁性肝硬変[39]等の肝機能障害があらわれるのが通常である。
- 腹膜
- 漿膜炎としてのループス腹膜炎の頻度は高くない。
- 膀胱
合併疾患
一般に膠原病は、他の膠原病を合併しやすい傾向がある。もっとも多いのは抗リン脂質抗体症候群である。シェーグレン症候群も合併しやすい。そのほか皮膚筋炎・多発筋炎、全身性強皮症との合併もある。特に後者との合併は、それぞれの診断基準を完全に満たすならオーバーラップ症候群といわれるし、すべての診断基準を不完全にしか満たさないものの中には混合性結合組織病という別の疾患に診断されるものもある(この疾患が完全に別の疾患であるのか、単に各膠原病の不全型にすぎないのかは議論があるが、日本では別の疾患としてとらえられ、厚生省の特定疾患の一つに挙げられている)。
検査
- 脳梗塞、肺塞栓などが生命予後を左右する。
治療
SLEはかつて死に至る病であったが、1950年代のステロイド系抗炎症薬(ステロイド)の登場とともに生存率、QOLのいずれにおいても劇的に改善した。
本症におちいった患者は、安定していても終生少量のステロイド(プレドニゾロン)を服用しつづける必要がある。これについては、厳密に科学的または疫学的な根拠があるわけではない。というのも、本症に対してステロイドの投与をやめてみる医者などというものが存在しないからである。とはいっても、自発的に内服をやめてしまった患者の観察などにより、おそらく終生飲み続けなければいけないであろうことは国際的なコンセンサスとなっている。このコンセンサスは強力であって、たとえば他の膠原病である皮膚筋炎・多発性筋炎やベーチェット病などではステロイドをやめることは可能といわれているが、特に全身性エリテマトーデスにおいてのみ不可能であると考えられている。逆に、終生ステロイドを飲み続けていると、本症を完全におさえこんだまま一生を終えることはまれではないであろう。むしろそういったケースではステロイドの副作用(浮腫やうつ状態・白内障)が目立つことになるわけである。
本症を急激に発症した最初のときと、CNSループス、ループス腎炎や血液学的異常(血小板減少など)の急激な増悪(フレア・アップ)が起こったときには、強力な治療が行われる。高用量のステロイド内服、ステロイドパルス療法、シクロフォスファミドパルス療法などが行われ、そのほか病態に応じては血漿交換や免疫グロブリン大量投与が行われることがある。またステロイド抵抗性やステロイド依存性の場合には、アザチオプリン、メトトレキサート、シクロスポリン、タクロリムス、シクロホスファミド[42]などの免疫抑制剤を継続的に使用する。
ミコフェノール酸モフェチル(MMF)はシクロフォスファミド(CYC)と同等の効果がある免疫抑制剤で副作用は少ない[43]。マラリア治療薬であるヒドロキシクロロキンも免疫抑制作用がありSLEへの投与が認可されている。自己幹細胞の移植による治療法も研究されており、さらにヒトゲノムの解読による治療法の研究も加速している。
その他の治療法として、リツキシマブ、CAR-T細胞によるB細胞の除去や、造血幹細胞移植による免疫系の再構築が研究されている。リツキシマブは、日本では既存治療で効果不十分なループス腎炎に対して承認されている[44]。CAR-T細胞は、2024年現在研究中であるが、症状の寛解および免疫抑制療法の中止が可能であることが報告されている[45]。
発熱、皮膚症状の増悪などマイナーな病勢の悪化に対しては、中等量のステロイド投与や、ステロイド軟膏を使用することが多い。関節痛に対しては非ステロイド性抗炎症薬が使用される。光線過敏症がある場合には日光を避ける生活が必要となる。腎症が悪ければタンパク制限が必要となる。
特記事項
- 薬剤が原因となる薬剤誘発性ループスが知られている。原因物質の休止によって軽快することが多い。SLEの診断基準からは除外されている。
- SLE罹患の母親から生まれた乳幼児は健康であることが多いものの、妊娠した母親は出産までSLE治療を継続するべきとされる。新生児ループスは稀である。妊娠によって内因性のステロイドが増加するので経過中はSLEの病状は安定することが多いが、出産後には増悪することが多い。詳細は「全身性エリテマトーデスと妊娠(英語版)」を参照
関連項目
- 膠原病
- 膠原病学
- 自己免疫疾患
- セリアック病
- ベーチェット病
- 抗リン脂質抗体症候群
- フェルティ症候群 - 類似した病像を呈し、鑑別診断が必要。
- 薬剤誘発性ループス - 薬剤によりSLE様症状を呈した状態。
- 円板状エリテマトーデス(DLE) - SLEの前駆症状であることがある。
- 後藤邑子 - 声優。患者であることを公表している。
脚注
外部リンク
- 全身性エリテマトーデス(指定難病49) - 難病情報センター
- 全身性エリテマトーデス - 大阪大学
