Utente:Miri346/Sandbox
Vena oftalmica superiore
La vena oftalmica superiore, tra le vene situate nella cavità orbitaria, è quella che presenta il calibro e il diametro maggiore e costituisce una fondamentale via di drenaggio venoso orbitale. [1]
Il suo diametro può variare da 2 a 10 millimetri.[2]

A differenza di altre vene, non presenta valvole.
Origine e Topografia
Il suo decorso nella regione superiore della cavità orbitaria è corrispondente a quello dell'arteria oftalmica.
Origina, posteriormente all’estremità mediale della palpebra superiore, dalla confluenza della vena nasofrontale con una radice venosa connessa alla vena sopraorbitaria, la quale unendosi con le vene sopratrocleari, dà origine alla vena angolare che affluisce alla vena facciale, con cui la vena oftalmica superiore è quindi in comunicazione. Si dirige posteriormente, nell’angolo tra le pareti superiore e mediale dell’orbita, accompagnando l’arteria oftalmica e, dopo aver attraversato la fessura orbitaria superiore, nella sua porzione mediale, sbocca nell’estremità anteriore del seno cavernoso.
Nella maggior parte dei casi però, la vena oftalmica superiore prende anastomosi con la vena oftalmica inferiore, insieme alla quale forma la vena oftalmica che raggiunge il seno cavernoso attraverso la fessura orbitaria superiore. Altre volte, invece le due vene possono aprirsi nel seno cavernoso in modo indipendente.[3]
Vasi affluenti
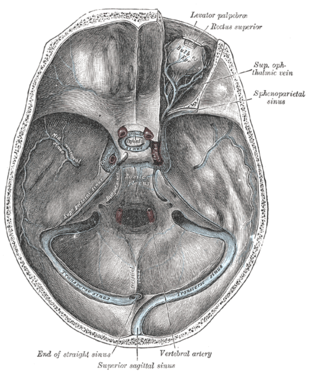
I rami affluenti della vena oftalmica superiore sono:[4]
- vena etmoidale anteriore
- vena etmoidale posteriore
- vene vorticose superiori
- vene palpebrali
- vene congiuntivali
- vene ciliari anteriori
- vene ciliari posteriori
Rapporti con le vicine strutture anatomiche
Rapporto con i nervi
La vena oftalmica superiore decorre attraverso la fessura orbitaria superiore in stretto rapporto con i seguenti nervi cranici e fibre nervose[2]:
- nervo oculomotore (III paio di nervi cranici)
- nervo trocleare (IV paio di nervi cranici)
- nervo oftalmico (prima branca del nervo trigemino, V paio di nervi cranici)
- nervo abducente (VI paio di nervi cranici)
- fibre simpatiche del plesso cavernoso
Rapporto con i muscoli
La vena oftalmica superiore decorre in posizione mediale rispetto all'inserzione del tendine del muscolo retto superiore. Inoltre, decorre in posizione diagonale rispetto al bordo laterale del muscolo retto superiore in prossimità dell'anello di Zinn, a livello della faccia posteriore della cavità orbitaria [2].
Angiogenesi (Embriologia)
La vena oftalmica superiore si origina dal mesoderma e si differenzia attraverso differenti e molteplici sostanze endogene, tra cui il fattore di crescita dell'endotelio vascolare (VEGF) e il fattore di crescita trasformante β (TGF- β). Questo processo avviene a partire dalla primitiva vena mascellare durante la nona settimana di gravidanza.[4]
Patologie
Esistono varie patologie che coinvolgono direttamente o indirettamente la vena oftalmica superiore tra cui[4]:
- Aumento della pressione intracranica: un aumento del diametro normale della vena è correlato ad un aumento della pressione intracranica che può determinare l'insorgenza di semplici sintomi, come ad esempio cefalee, nausea, vomito, come anche situazioni patologiche fra cui, l'edema della papilla e l'ulcera di Cushing. La prima può arrivare a causare un oscuramento della vista fino a una possibile perdita di essa, mentre la seconda è un'ulcera, probabilmente causata da un'aumento della produzione di succhi gastrici, dovuta a un'eccessiva stimolazione vagale determinata dall'aumento della pressione intracranica.
- Pseudotumore orbitale: questa patologia è causata da un'infezione che provoca la formazione di un'edema, che aumentando di dimensione, comprime la vena oftalmica superiore andando a causare una stasi venosa, la quale a sua volta può determinare in casi molto rari, il distacco della coroide.
- Orbitopatia di Graves: questa patologia provoca dei rigonfiamenti a livello delle palpebre che di conseguenza causano una riduzione del flusso sanguigno a livello orbitario, precisamente a livello delle vene oftalmiche. Questa patologia però può essere tenuta sotto controllo o attraverso farmaci o attraverso una decompressione chirurgica senza quindi causare danni permanenti.
- CCF ( Fistola del seno carotide-cavernoso): questa patologia è causata da un afflusso di sangue arterioso proveniente dalla carotide, a livello del seno cavernoso (seno di confluenza venosa). Questa unione provoca un ristagno del sangue venoso, determinato da un'aumento pressorio, che porta ad una dilatazione del diametro della vena oftalmica superiore. Questo aumento può, se non trattato in maniera diretta, provocare la perdita della vita al paziente.
Considerazioni chirurgiche
L'incannulazione diretta della vena oftalmica superiore è un approccio fondamentale per il trattamento delle fistole del seno carotideo-cavernoso indirette (CCF). Quando le tecniche convenzionali di avvolgimento percutaneo falliscono o sono anatomicamente difficili, si può pensare di avere un approccio alla vena oftalmica superiore, in modo da accedere a queste lesioni.
Quella che segue è una breve descrizione del metodo chirurgico[4]:
- Il paziente viene portato in sala angiografica e adagiato in posizione supina dopo aver conferito il consenso informato.
- Il viso del paziente viene preparato in modo sterile secondo i protocolli di chirurgia oculoplastica e un anestetico locale viene iniettato a livello della palpebra superiore.
- Viene eseguita un'incisione a livello della cute, nella piega della palpebra superiore con una lama numero 15. Il setto orbitario viene così inciso con forbici di Westcott o cauterio monopolare.
- Il grasso pre-aponeurotico viene reciso fino al raggiungimento di un vaso affluente arterializzato dalla vena oftalmica superiore, che può essere seguito fino al tronco principale da essa. Il chirurgo quindi isola, espone ed entra nella parete della vena oftalmica superiore con un angiocatetere.
- Una volta determinata la posizione del catetere e l'avvolgimento, vengono iniettati agenti embolici liquidi per occludere il seno cavernoso.
- La vena oftalmica superiore viene obliterata tramite sutura. Nel caso in cui la vena abbia un diametro troppo grande e una parete troppo spessa viene richiusa mediante l'utilizzo della chiusura primaria.
- Viene eseguita dal chirurgo la chiusura dell'incisura cutanea.
Raramente, l'approccio sopracitato può fallire. In questi casi un'opzione valida è rappresentata dalla puntura percutanea della vena oftalmica inferiore.
In queste procedure chirurgiche la collaborazione tra il chirurgo oftalmico, il neurochirurgo e il radiologo interventista può migliorare i risultati del paziente.[5]
Misurazione del flusso sanguigno della vena oftalmica superiore
Un metodo approvato e non invasivo per la misurazione del sangue intracranico e dei flussi cerebrospinali è la PC-MRI (risonanza magnetica a contrasto di fase). Attraverso uno studio del 2018[6] è stato misurato il flusso sanguigno della vena oftalmica superiore tramite questa tecnica, considerata valida. Considerando i risultati piuttosto positivi, probabilmente la tecnica verrà utilizzata con maggiore frequenza in futuro.
Questa tecnica molto innovativa potrebbe sostituire nel corso degli anni la tecnica di imaging vascolare dell'ecografia Doppler che presenta delle limitazioni:
- Necessità di un operatore addestrato per svolgere l'ecografia.
- Necessità di un contatto diretto tra la palpebra e la sonda, che potrebbe influenzare la pressione intraoculare e il flusso sanguigno orbitale.
- La misurazione dei valori del flusso sanguigno è difficoltosa poiché la sezione trasversale del vaso preso in esame non può essere calcolata direttamente.
La PC-MRI invece rende visibile e permette di stimare il flusso sanguigno di una determinata regione senza la necessità di iniettare alcun agente di contrasto[6].
Note
Altri progetti
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/18px-Commons-logo.svg.png Wikimedia Commons contiene immagini o altri file su vena oftalmica superiore
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/18px-Commons-logo.svg.png Wikimedia Commons contiene immagini o altri file su vena oftalmica superiore
Modificazione post-traduzionale
Da Wikipedia, l'enciclopedia libera.
| Questa voce sull'argomento biologia molecolare è solo un abbozzo. Contribuisci a migliorarla secondo le convenzioni di Wikipedia. Segui i suggerimenti del progetto di riferimento. |
Una modificazione post-traduzionale è la modifica chimica di una proteina in seguito alla sua traduzione. Infatti, a volte, queste proteine hanno bisogno, per svolgere la propria funzione, di essere modificate[1].
Ogni proteina è un polipeptide composto da una catena in cui possono essere incorporati (durante la sintesi proteica vera e propria) 20 diversi amminoacidi. Molti di questi amminoacidi possono essere modificati attraverso l'aggiunta di alcuni gruppi funzionali in grado di allargare la funzionalità complessiva della proteina. Un ulteriore tipo di modificazione post-traduzionale è la rimozione di amminoacidi dalla regione N-terminale della proteina attraverso l'azione di una proteasi o anche la degradazione di una proteina in più parti. Allo stesso tempo, però, a volte le proteine possono essere prodotte separatamente per poi essere assemblate durante queste modificazioni, come ad esempio l'emoglobina.
Nel corso del tempo sono state identificate un numero notevole di modifiche post-traduzionali. Queste modifiche tendono a creare variazioni a livello delle funzionalità e delle caratteristiche stesse delle proteine, andando sicuramente ad intaccare la loro struttura tridimensionale, la loro attività, la loro localizzazione cellulare e la possibilità di interazioni con altre molecole, infatti una singola proteina può permanere nelle cellule in forme biologiche differenti[2].
Le modifiche post-traduzionali sono le seguenti:
- Glicosilazione
- Fosforilazione
- Acetilazione
- Metilazione
- Nitrosilazione
- ADP-ribosilazione
- Lipidazione
- Proteolisi
La glicosilazione è il processo post-traduzionale più comune e diffuso, infatti è quello che determina la maggior parte delle modifiche proteiche, andando ad ampliare notevolmente il "corredo" proteosomico.[3]
Questa modifica prevede l'aggiunta di zuccheri a livello della catena polipeptidica e può avvenire in zone differenti della cellula, come ad esempio nel RER, ovvero il reticolo endoplasmatico rugoso o nell'apparato del Golgi. Inoltre, alcune di queste modifiche possono essere considerate modifiche co-traduzionali, ovvero che avvengono durante la sintesi della proteina stessa, come nel caso dell'N-glicosilazione.

Esistono vari tipi di glicosilazione:
- N-glicosilazione o N-linked: è la più frequente e rappresenta circa il 90% dei casi. Prevede l'aggiunta di un glicano pre-formato all'azoto ammidico dell'asparagina.
- O-glicosilazione o O-linked: è meno frequente della precente, anche se è quasi sempre sequenziale alla N-glicosilazione. Questa modifica prevede l'aggiunta di monosaccaridi a livello del gruppo idrossilico di serina e treonina. A volte avviene anche a livello di residui di idrossiprolina e di idrossilisina.
- Glipiazione: questo tipo di modifica è una glicosilazione di recente scoperta che si riscontra sia a livello di cellule eucariote , sia a livello degli archeobatteri. Questa modifica prevede la formazione di un legame covalente tra la proteina di partenza e il GPI (glicosilfosfatidilinositolo). Questo tipo di glicosilazione è fondamentale, in quanto serve a stabilizzare molecole solubile a livello della membrana plasmatica.
- C-glicosilazione o C-linked: questa modifica prevede il legame di una molecola di mannosio a livello dell'anello indolico del triptofano.
- Fosfoglicosilazione: questa modifica post-traduzionale prevede il legame di un glicano a livello di una serina, in questo caso mediante un legame fosfodiesterico.
Patologie correlate ad una glicosilazione anomala
Negli ultimi anni è stato visto come difetti a livello del processo di glicosilazione siano alla base di molte patologie umane[3]:
- Disordini congeniti della glicosilazione: sono patologie che presentano disturbi neurologici e di sviluppo, determinate da un assemblaggio errato durante il processo di N-glicosilazione.
- Botulismo e colite pseudomembranosa: queste patologie sono correlate ad una tossina prodotte dal batterio Clostridium. Essa determina la glicosilazione della proteina Rho, fondamentale per l'organizzazione strutturale nelle cellule eucariotiche. Questa proteina è ad attività GTPasica e quindi per funzionare necessita di GTP, ma nel momento in cui il GTP si cerca di legare, ciò non riesce in maniera ottimale, in quanto la modifica ha determinato un'alterazione della struttura di legame.
- Trasformazioni neoplastiche: alcune proteine che vengono erroneamente glicosilate possono indurre le fasi del processo neoplastico, principalmente l'angiogenesi e la metastasi.
La fosforilazione è una modifica che consta nell'aggiunta a livello dei gruppi ossidrili di serina, treonina e tirosina di un gruppo fosfato. Questo meccanismo viene sviluppato da un enzima che prende il nome di chinasi. Il processo inverso prende il nome di defosforilazione e viene attuato da un altro enzima che prende il nome di fosfatasi. Questi due processi sono implicati nella modifica funzionale delle proteine, come ad esempio rendendole più inclini alla degradazione.

Questo processo però è interessante in quanto, grazie all'azione di un adeguato stimolo, la fosforilazione avviene rapidamente e con un raggio d'azione ampio[3].
L'acetilazione prevede l'aggiunta a livello di una lisina di un gruppo acetile che può derivare da diversi donatori, normalmente l'acetii-Coenzima-A.
Questa forma di modifica è fondamentale a livello istonico, in quanto contribuisce in modo decisivo allo sviluppo e al ripiegamento dei nucleosomi con successiva formazione della cromatina. Inoltre, concorre a regolare l'espressione genica in base alle necessità metaboliche della cellula.[3]
La metilazione prevede l'aggiunta di un gruppo metilico, grazie all'enzima metiltransferasi, su una lisina o un arginina (maggiore modifica a livello dei mammiferi). Inoltre, anche i gruppi carbossilici e le strutture N-terminali della proteina, anche se più raramente, possono essere attaccati dal gruppo metilico stesso. Questo gruppo metilico può derivare da donatori, quali ad esempio S-adenosilmetionina.
Questa forma di modifica è fondamentale, come l'acetilazione, a livello istonico.[3]
[3] La nitrosilazione o anche S-nitrosilazione prevede l'aggiunta covalente di una molecola di ossido d'azoto (NO) a livello di una cisteina e in casi rari a livello del triptofano e di gruppi amminici, composti della lisina e dell'N-terminale della proteina. Questa modifica avviene prevalentemente in presenta di alte quantità di ossigeno, in quanto la cisteina e NO non presentano un'elevata reattività.
A differenza di altre modifiche, questa presenta una peculiarità, ovvero non è catalizzata da enzimi, ma dipende dalla reattività chimica delle molecole di NO e dell'accettore d'interesse.
[3]L'ADP-ribosilazione prevede l'aggiunta di una o più molecole di ADP-ribosio mediante differenti enzimi:
- La mono ADP-ribosiltransferasi aggiunge una molecola di ADP-ribosio al residuo amminoacidico di arginina.
- La poli ADP-ribosilpolimerasi lega le unità di ADP-ribosio attraverso un legame 1"-2' e successivamente assembla il polimero a livello di residui amminoacidici differenti in base alla proteina bersaglio.
Queste modifiche sono entrambe reversibili: la prima grazie all'azione di ADP-ribosilidrossilasi, mentre la seconda mediante specifiche idrolasi. Questa modifica è fondamentale nei processi di modulazione dell'espressione genica e anche di eventi di riparazione del DNA, di tumorigenesi e di apoptosi.
Un aspetto interessate riguardo questa modifica post-traduzionale è come possa essere la causa della tossicità e patogenicità di alcuni batteri, come ad esempio il Coeynebacterium diphteriae. La sua pericolosità è dovuta dal fatto che la tossina da esso prodotta ha un'attività ADP-ribosiltransferasi. Questa tossina catalizza la modificazione (ADP-ribosilazione) su un residuo di istidina di un fattore implicato nella fase di allungamento della traduzione, determinando il blocco della sintesi proteica e quindi l'apoptosi cellulare.
La lipidazione o prenilazione consiste nell'aggiunta di un gruppo lipidico a una catena polipeptidica tramite legame covalente[3]. Questo processo può avvenire sia a livello delle porzioni N-terminale e C-terminale delle proteine, ma anche a livello delle catene laterali. [4]
La lipidazione incrementa l'idrofobicità delle proteine provocando modifiche alla loro conformazione, stabilità, associazione di membrana, localizzazione, traffico e affinità di legame con i loro cofattori.[5]
Le proteine possono modificare in modo covalente da almeno sette tipi di lipidi:[6]
- Acidi grassi: come ad esempio la mirisitilazione e palmitilazione
- acidi lipoici: questa modifica si riscontra prevalentemente associata a tumori, disordini metabolici e malattie mentali.
- Isoprenoidi
- Steroli, come per esempio l'aggiunta di colesterolo, prevalentemente al dominio C-terminale
- Fosfolipidi
- Glicosilfosfatidilinositolo (GPI)
- Elettrofili derivati dai lipidi (LDE)

La proteolisi è stata considerata per molto tempo un processo soltanto degradativo. In realtà oggi è chiaro che si tratta di un processo ubiquitario che rientra nella categoria delle modifiche post-traduzionali delle proteine di tipo irreversibile. Sono molti i processi in cui proteine, enzimi e ormoni vengono attivati all'interno di processi cellulari. Un esempio è quello dell'insulina, peptide responsabile del corretto assorbimento del glucosio.
L'insulina viene prodotta dalle cellule β del pancreas sottoforma di un precursore inattivo, cioè la pre-proinsulina formata da 110 amminoacidi. Quest'ultima mediante la formazione di ponti disolfuro tra i suoi amminoacidi si trasforma in proinsulina, formata da 79 a 86 amminoacidi a seconda della specie animale. Questa catena è composta da tre segmenti:
- N-terminale che prende il nome di catena B
- C-terminale che prende il nome di catena A
- Il segmento intermedio che prende il nome di peptide C.
Il peptide C viene rimosso attraverso un taglio proteolitico da parte di un endopeptidasi con la formazione dell'insulina attiva.[7]
Note
Altri progetti
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/18px-Commons-logo.svg.png Wikimedia Commons contiene immagini o altri file su glicosilazione
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/18px-Commons-logo.svg.png Wikimedia Commons contiene immagini o altri file su alcune modifiche post-traduzionali, come metilazione, acetilazione e fosforilazione
- https://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Commons-logo.svg/18px-Commons-logo.svg.png Wikimedia Commons contiene immagini o altri file su processo di formazione dell'insulina