Apolipoproteína H
A apolipoproteína H (Apo-H), tamén chamada β2-glicoproteína 1 ou beta-2 glicoproteína 1 (β2-GP1), é unha proteína do plasma multifuncional de 38 kDa que nos humanos está codificada no xene APOH do cromosoma 17.[1] Unha das súas funcións é unirse á cardiolipina. Cando se une, as estruturas da cardiolipina e da apolipoproteína H sofren grandes cambios.[2] Formando parte da estrutura da Apo-H hai un tramo de aminoácidos cargados positivamente (nas posicións da secuencia 282-287), Lys-Asn-Lys-Glu-Lys-Lys, que están implicados na unión a fosfolípidos.[3]
| APOH | |||
|---|---|---|---|
| Estruturas dispoñibles | |||
| PDB | Buscar ortólogos: PDBe, RCSB | ||
| Identificadores | |||
| Nomenclatura | Outros nomes
| ||
| Símbolo | APOH (HGNC: 616) | ||
| Identificadores externos | |||
| Locus | Cr. 17 q24.2 | ||
| Padrón de expresión de ARNm | |||
 | |||
| Máis información | |||
| Ortólogos | |||
| Especies |
| ||
| Entrez |
| ||
| Ensembl |
| ||
| UniProt |
| ||
| RefSeq (ARNm) |
| ||
| RefSeq (proteína) NCBI |
| ||
| Localización (UCSC) |
| ||
| PubMed (Busca) |
| ||
A ApoH ou β2-GP1 ten unha complexa implicación na aglutinación. Parece alterar a aglutinación de plaquetas mediada por adenosín difosfato (ADP).[4] Normalmente, a β2-GP1 ten unha actividade de anticoagulación no soro (ao inhibir factores de coagulación); porén, os cambios nos factores sanguíneos poden resultar na reversión desa actividade.
Aínda que esta proteína recibiu o nome de apolipoproteína H (e o seu símbolo en HGNC é APOH), non está presente en cantidades apreciables nas fraccións das lipoproteínas, polo que ApoH é, por tanto, un nome pouco apropiado e utilízase tamén o nome de β2-glicoproteína 1.[5]
Actividades inhibitorias
A β2-GP1 ou ApoH parece inhibir completamente a liberación de serotonina polas plaquetas[6] e impide sucesivas vagas de agregación inducida por ADP. A actividade de β2-GP1 parece implicar a unión de compostos aglutinantes, cargados negativamente e inhibe a aglutinación por activación por contacto da vía de coagulación sanguínea intrínseca.[7] A β2-GP1 causa unha redución dos sitios de unión da protrombinase nas plaquetas e reduce a activación causada polo coláxeno cando a trombina está presente a concentracións fisiolóxicas séricas de β2-GP1, o que suxire un papel regulatorio da β2-GP1 na coagulación.[8]
A β2-GP1 tamén inhibe a xeración de factor Xa en presenza de plaquetas.[9] A β2-GP1 tamén inhibe activación do factor XIIa.[10]
Ademais, a β2-GP1 ou ApoH inhibe a activación da proteína C bloqueando a súa actividade en vesículas de fosfatidilserina:fosfatidilcolina,[11] pero unha vez a proteína C se activa, a Apo-H non pode inhibir a actividade. Como a proteína C está implicada na degradación do factor Va, a Apo-H inhibe indirectamente a degradación do factor Va.[12] Esta actividade inhibitoria diminúe cando se engaden fosfolípidos, o que parece indicar que a inhibición pola Apo-H da proteína C é competitiva cos fosfolípidos.[13] Isto indica que en certas condicións a Apo-H asume propiedades procoagulativas.
Patoloxía
Os anticorpos anti-β2-GP1 poden encontrarse en doenzas tanto infecciosas coma algunhas autoinmnes sistémicas (por exemplo, o lupus eritematoso sistémico).[14] A positividade para anticorpos anti-cardiolipina en tests de diagnóstico da síndrome antifosfolípidos autoinmune require a presenza de β2-GP1 no extracto de cardiolipina.[15][16] Os anticorpos anti-β2-GP1 están claramente asociados con formas trombóticas de lupus.
Dominio proteico Sushi 2
| Sushi_2 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
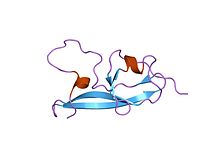 Estrutura de RMN do quinto dominio da beta-2 glicoproteína 1 humana | |||||||||
| Identificadores | |||||||||
| Símbolo | Sushi_2 | ||||||||
| Pfam | PF09014 | ||||||||
| InterPro | IPR015104 | ||||||||
| |||||||||
En bioloxía molecular o dominio proteico Sushi 2 tamén se coñece como o quinto dominio proteico da beta-2-glicoproteína 1 (β2-GP1 ou ApoH). Este dominio proteico só se encontra en eucariotas. Os primeiros catro dominios que se encontran na apolipoproteína H son todos semellantes, mais o quinto parece ser diferente.[17]
Estrutura
Este dominio proteico está composto por catro febras beta antiparalelas ben definidas e dúas curtas hélices alfa, así como un bucle longo e altamente flexible.[18] Adicionalmente, o quinto dominio proteico parece asemellarse aos outros catro na apolipoproteína coa excepción de tres pontes disulfuro internas e un bucle extra C-terminal.[17]
Función
A súa función exacta aínda non foi completamente dilucidada; porén, sábese que desempeña un importante papel na unión de β2-GP1 a compostos cargados negativamente e a subseguinte captura para a unión de anticorpos anti-β2-GP1.[18] O desenvolvemento de anticoros contra β2-GP1 pode orixinar a síndrome antifosfolípidos que a miúdo causa complicacións no embarazo.[17]
Notas
Véxase tamén
Ligazóns externas
- Apolipoprotein H Medical Subject Headings (MeSH) na Biblioteca Nacional de Medicina dos EUA.
- Apolipoprotein H and Applied Research Arquivado 18 de decembro de 2014 en Wayback Machine.
- Localización no xenoma humano de APOH e páxina con detalles sobre o xene APOH no UCSC Genome Browser.
- PDBe-KB proporciona un resumo de toda a información sobre estruturas dispoñible en PDB da apolipoproteína H humana (B2G1)