Vitamine B1
La thiamine ou vitamine B1 (ou encore aneurine) est une vitamine hydrosoluble de la famille des vitamines B que les animaux doivent trouver dans leur alimentation. Elle est synthétisée par les bactéries, les plantes et les champignons.
| Thiamine | |
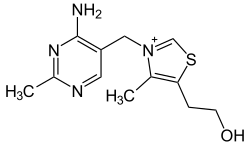  Structure de la thiamine | |
| Identification | |
|---|---|
| Nom UICPA | 3-[3-[(4-amino- 2-methyl- pyrimidin- 5-yl) methyl]- 4-methyl- thiazol- 5-yl] ethanol |
| Synonymes | vitamine B1, aneurine |
| No CAS | |
| No CE | 200-425-3 |
| Code ATC | A11 |
| DrugBank | DB00152 |
| PubChem | 6042 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H17N4OS |
| Masse molaire[1] | 265,355 ± 0,017 g/mol C 54,32 %, H 6,46 %, N 21,11 %, O 6,03 %, S 12,08 %, |
| Propriétés physiques | |
| T° fusion | 248 °C (décomposition)[2] |
| Solubilité | 1 g·mL-1 (eau); 1 g·100 mL-1 (alcool) ; |
| Écotoxicologie | |
| DL50 | 301 mg·kg-1 (souris, s.c.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier | |
C'est un précurseur métabolique de la thiamine pyrophosphate (TPP), une coenzyme essentielle et indispensable au bon fonctionnement du système nerveux et des muscles.
Chez l'être humain, une carence alimentaire en vitamine B1 cause le béribéri et peut aussi causer une encéphalopathie de Gayet-Wernicke.
Histoire
Dans les années 1880, le béribéri sévit de façon épidémique chez les troupes de l'armée indienne britannique, et à bord des navires des puissances coloniales en Extrême-Orient. Cette maladie est considérée soit comme une infection, soit comme une intoxication[4].
En 1897, Eijkman démontre qu'il s'agit d'une maladie nutritionnelle en provoquant un beribéri expérimental chez la poule, guérissable en remplaçant le riz décortiqué, par du riz complet[4]. Il reçoit pour cela le prix Nobel de médecine en 1929.
En 1911, Umetarō Suzuki découvre une substance guérissant le béribéri, à partir du son, pour la nommer acide abérique[5]. Cependant, ces travaux n'ont pas été immédiatement remarqué par la communauté scientifique de l'époque, car Eijkman publiait en néerlandais et Suzuki en japonais[4].
En 1912, Kazimierz Funk décrit une substance naturelle, hydrosoluble et aminée qu'il appelle « vitamine » (littéralement amine vitale)[6] qu'il croit à tort être le facteur actif contre le béribéri[4].
En 1926, B.C.P Jansen (en) et Willem Frederik Donath (nl) parviennent à isoler la vitamine B1 de la cuticule du riz, mais ils la caractérisent mal en omettant l'atome de soufre, et les autres chercheurs n'ont pu reproduire leurs travaux[4].
En 1933, Robert R. Williams établit la formule chimique définitive de la vitamine B1 en l'appelant thiamine. Il en réalise la synthèse complète en 1936 et en obtient le brevet. Il s'associe avec Merck & Co pour une production commerciale. Il démontre que la thiamine synthétique est identique, chimiquement et biologiquement, à la thiamine naturelle ; et que la synthèse industrielle est plus économique que l'extraction à partir de source naturelle[4].
La production mondiale de thiamine passe de 100 kg en 1937 à 200 tonnes en 1967[4].
Besoins en vitamine B1
Les besoins en vitamine B1 sont principalement dépendant des apports en glucides sur le métabolisme desquels elle intervient[7]. Ils sont ainsi fonction du poids corporel, de l’intensité du métabolisme, du niveau d’activité physique et de la composition de la ration alimentaire[8]. Les références nutritionnelles peuvent être exprimées en mg par mégajoule (mg/MJ) d’énergie consommées plutôt qu’en mg/j, avec une valeur de 0,1 mg/MJ pour la référence nutritionnelle pour la population (RNP)[7].
Cette valeur se décline en mg/j selon les types de populations et leur consommation moyenne avec une base d'apport journalier d'environ 1,5 mg/j pour les hommes adultes et 1,2-1,3 mg/j pour les femmes[9],[8] et des recommandations jusqu'à 1,8 mg/j pour la femme enceinte[8].
Sources
La thiamine est naturellement présente dans les produits alimentaires ou apportée sous la forme de suppléments[10].
Les aliments les plus riches en thiamine sont les céréales entières, la viande de porc, et les noix[10],[11].
Le corps humain peut aussi obtenir de la thiamine à partir du microbiote du gros intestin, mais en quantité insuffisante pour compenser un déficit[11].
| Aliment | Teneur (mg/100 g) |
|---|---|
| Graine de tournesol séchée | 2,2964[12] |
| Germe de blé | 2,05[13] |
| Levure de bière sèche | 1,82[13] |
| Graines de soja | 1,3[13] |
| Levure de boulanger (à ne pas confondre avec la levure chimique) | 1 - 2 |
| Œufs de poisson | 1 - 1,2 |
| Noix de macadamia | 1,195[12] |
| Salami sec | 0,93[12] |
| Graine de pavot | 0,849[12] |
| Pistache | 0,84[12] |
| Bacon cru | 0,751[12] |
| Chipolata | 0,741[12] |
| Jambon | 0,741[12] |
| haricots secs et petits pois | 0,68[13] |
| Noix de pécan | 0,66[12] |
| Paprika | 0,645[12] |
| Chorizo | 0,63 [12] |
| Graine de cumin | 0,628[12] |
| Noix du Brésil | 0,617[12] |
| Porc | 0,6 - 0,95[13] |
| Petit lait séché | 0,5[13] |
| Noix, noisettes | 0,5 |
| Lentilles sèches | 0,43 |
| Rognons | 0,37 |
| Riz complet | 0,3[13] |
| Foie de bœuf | 0,3[13] |
| Châtaignes | 0,2 - 0,3 |
| Amandes, cacahuètes | 0,2 - 0,3 |
| Pain complet | 0,25 |
| Huîtres | 0,25 |
| Poisson | 0,05 - 0,09[13] |
| Asperge | 0,143 |
| Pomme de terre | 0,17[13] |
| Œufs | 0,07[13] |
| Végétaux (fruits, feuilles, tiges, racines) | 0,06 - 0,07[13] |
| Chou-fleur | 0,057 |
| Chou frisé | 0,053 |
| Lait entier | 0,03 - 0,07[13] |
| Riz blanc | 0,05[13] |
La thiamine peut être altérée par les sulfites utilisés comme conservateurs notamment dans les fruits et légumes, viande maigre et charcuterie ; par le chlore résiduel de l'eau de cuisson ; par la présence d'ions cuivre, autant de circonstances qui peuvent entrainer une perte de thiamine[11].
La stabilité de la thiamine est bonne en solution acide (jus de fruits et boissons acides). Elle est dégradée en condition neutre ou alcaline : la pratique d'ajouter du bicarbonate de sodium à la cuisson des légumes pour conserver leur couleur entraine une perte de thiamine (milieu alcalin)[11].
La thiamine est aussi dégradée par des agents oxydants ou réducteurs, et par les rayonnements. Elle est sensible à la chaleur, et du fait de sa solubilité, elle a tendance à s'échapper dans l'eau de cuisson[11].
La thiamine n'est pas répartie également dans les céréales entières. Des processus de meunerie (farine de céréale) peuvent réduire le taux de thiamine de plus de 40 % par rapport à la farine de céréale complète, et ceux de polissage du riz de plus de 75 % par rapport au riz complet[11].
Les autres modes de cuisson (rotissage, friture…) entrainent aussi une perte de thiamine, notamment pour les viandes. Une viande grasse perd moins de thiamine à la cuisson qu'une viande maigre, et une viande panée contient 15 à 40 % de thiamine en plus que son équivalente non panée[11].
La cuisson à la vapeur est le meilleur mode de cuisson pour limiter la perte de thiamine, et le riz étuvé contient plus de thiamine que le riz non étuvé. Cependant, si la transformation des aliments a le plus souvent un effet négatif sur la teneur en thiamine, il faut souligner que cette transformation peut être nécessaire pour minimiser des constituants nocifs[11].
Métabolisme
Structure et biosynthèse
La thiamine est composée d'un cycle pyrimidique et d'un cycle thiazolique, reliés par un pont méthylène fragile de grande thermolabilité[14].
La thiamine est biosynthétisée par les bactéries, certains protozoaires, des plantes, et des champignons[15],[16]. Les groupes thiazole et pyrimidine sont synthétisés séparément in vivo, puis combinés pour former du monophosphate de thiamine via l'enzyme thiamine-phosphate synthase.
Le système d'anneaux pyrimidine se forme au cours d'une réaction catalysée par la phosphométhylpyrimidine synthase (ThiC), une enzyme de la famille radical SAM (une métalloprotéine fer-soufre) qui utilise la S-Adénosylméthionine comme cofacteur[17],[18].
Absorption
La thiamine est absorbée au niveau de l'intestin grêle proximal (jéjunum). L'absorption dépend de la dose, elle est d'abord d'abord active à dose alimentaire jusqu'à 5 mg, et au delà (dose pharmacologique) elle se fait par diffusion passive[11],[14].
Les phosphatases intestinales hydrolysent la thiamine en une forme libre qui est alors absorbée. La thiamine absorbée est rapidement phosphorylée en pyrophosphate de thiamine (TPP) aussi appelé diphosphate de thiamine (TDP) ou cocarboxylase[11],[14].
L'absorption digestive de la thiamine peut être diminuée chez le sujet âgé, chez le sujet atteint de malabsorption, chez la personne alcoolique. En dépit d'un apport alimentaire suffisant, un déficit en thiamine peut être provoqué par un régime trop riche en hydrates de carbone, en thiaminases ou autres antagonistes de la thiamine[11].
Répartition
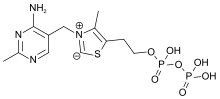
Dans le corps humain, cette forme phosphorylée est stockée principalement dans le cœur, le cerveau, le foie et les reins (organes à besoins énergétiques élevés)[11]. Dans le cerveau, le TPP est en partie à nouveau phosphorylé en triphosphate de thiamine (TTP)[14].
Cette forme stockée a une demi-vie courte de 14 à 18 jours, cette faible réserve explique la nécessité d'un apport permanent et régulier de thiamine alimentaire[10]. Un adulte moyen dispose d'une réserve corporelle d'environ 25-30 mg[11].
Dans le sang total la concentration en thiamine totale est de l'ordre de 75 à 200 nanomoles/L, près de 80 % de cette thiamine totale se trouve dans les érythrocytes sous forme de TPP[11].
Excrétion
L'excrétion de la thiamine est principalement urinaire. Au niveau du rein elle dépend à la fois de la filtration glomérulaire et de la réabsorption-excrétion tubulaire. Cette excrétion s'effectue de façon active via des transporteurs des cellules rénales tubulaires. En excès de thiamine dans l'organisme, la réabsorption se change en excrétion, les taux plasmatiques élevés de thiamine sont ainsi régulés de façon efficace[11].
Une utilisation prolongée de diurétiques peut induire un déficit en thiamine[11].
La thiamine est aussi excrétée par les feces (thiamine provenant de bactéries intestinales), la sueur et le lait. Dans le lait maternel, le taux de thiamine est de l'ordre de 0,14 à 0,21 mg/L selon le régime alimentaire[11].
Fonctions biochimiques
Les structures nécessaires à l'activité vitaminique de la thiamine sont :
- le groupement β hydroxyéthyl sur lequel s'effectue l'estérification en pyrophosphate de thiamine (TPP) ;
- la fonction amine primaire du noyau pyrimidique ;
- la présence d'un atome d'hydrogène sur le seul carbone non substitué du noyau thiazolique ;
- l'intégrité du pont méthyléne réunissant les deux noyaux.
Généralités
La vitamine B1 est indispensable à la transformation des glucides en énergie par le cycle de Krebs et à la transformation du pyruvate (toxique pour le système nerveux) produit par la glycolyse. De plus, elle est essentielle pour de nombreux autres processus cellulaires comme la synthèse des précurseurs des acides nucléiques, de la myéline, des neurotransmetteurs (acétylcholine) et pour son action anti-oxydante.
La thiamine pyrophosphate, comme coenzyme[19], est partie intégrante du site actif de l'enzyme qui l'utilise. La réaction globale peut s'écrire de la façon suivante :

Comment agit la thiamine ? La liaison carbonyle (oxo) est électriquement déséquilibrée, l'oxygène attirant les électrons. Ces carbones ont donc tendance à être positifs.
La thiamine va stabiliser une forme où le carbone qui va perdre le groupe R2 devient négatif (carbanion voir thiamine paragraphe Chimie) : il pourra y avoir alors une réaction entre le carbone + du carbonyle et le carbone - stabilisé par la thiamine. Le schéma réactionnel peut être le suivant :

Le mécanisme précis est bien décrit de la façon suivante :
Dans plusieurs réactions, y compris celle de la pyruvate déshydrogénase, de l'alpha-cétoglutarate déshydrogénase et de la transcétolase, le TPP catalyse la réaction de décarboxylation réversible (alias clivage d'un composé substrat au niveau d'une liaison carbone-carbone reliant un groupe carbonyle à un groupe réactif adjacent - généralement un groupe carboxylique acide ou un alcool). Il y parvient en quatre étapes de base :
- Le carbanion de l'ylure de TPP attaque de manière nucléophile le groupe carbonyle sur le substrat. (Cela forme une liaison simple entre le TPP et le substrat.)
- La liaison cible sur le substrat est rompue et ses électrons sont poussés vers le TPP. Cela crée une double liaison entre le carbone du substrat et le carbone TPP et pousse les électrons de la double liaison N-C dans le TPP entièrement sur l'atome d'azote, le réduisant d'une forme positive à une forme neutre.
- Dans ce qui est essentiellement l'inverse de la deuxième étape, les électrons repoussent dans la direction opposée formant une nouvelle liaison entre le carbone du substrat et un autre atome. (Dans le cas des décarboxylases, cela crée une nouvelle liaison carbone-hydrogène. Dans le cas de la transcétolase, cela attaque une nouvelle molécule de substrat pour former une nouvelle liaison carbone-carbone.)
- Dans ce qui est essentiellement l'inverse de la première étape, la liaison TPP-substrat est rompue, reformant l'ylure TPP et le substrat carbonyle.

Exemples d'enzymes à thiamine pyrophosphate (TPP)
Transcétolases
Ces enzymes appartiennent notamment à la voie des pentoses-phosphate et au cycle de Calvin. Il ne s'agit en aucun cas de cétolases malgré le nom consacré car, dans une cétolisation, c'est le carbone en alpha de la fonction oxo qui agit sur une autre fonction oxo.
Un exemple :

Pyruvate décarboxylase
Ce complexe enzymatique est composé de plusieurs enzymes. La première, enzyme à thiamine pyrophosphate, réalise la décarboxylation du pyruvate en éthanal (acétaldéhyde) qui est ensuite oxydé. Cette même réaction est réalisée dans la fermentation éthanolique, l'éthanal étant alors réduit en éthanol.Le schéma général présenté ci-dessus n'est pas facile à appliquer. En voici une présentation qui le reprend en inversant le sens :

Note : Les fonctions oxo sont développées par deux OH portés par le même carbone pour pouvoir expliquer la réaction.
α-acétolactate synthase
Dans la fermentation butanediolique, une grande partie de l'acide pyruvique est transformé en 2,3-butanediol par l'intermédiaire de la 3-hydroxybutanone. La condensation de deux acides pyruvique (pyruvate) est nécessaire, le composé obtenu étant décarboxylé deux fois. La première étape met en jeu une enzyme à TPP donnant l'α-acétolactate (2-hydroxy-2-méthyl-3-céto-butanoïque) dont la décarboxylation simple, en raison de la déstabilisation de la fonction carboxylique en β d'une fonction cétone, donne la 3-hydroxybutanone.
La réaction, toujours selon le même schéma, est la suivante.

Triphosphate de thiamine (TTP)
Cette forme de thiamine joue un rôle biologique non enzymatique, mais important et mal connu, dans le tissu nerveux (conduction de l'influx nerveux et neurotransmission)[14],[20].
Déficit et carence
La carence en thiamine (avitaminose) est très rare dans les pays industrialisés où elle est surtout liée à l'alcoolisme chronique et des états de dénutrition[14]. Dans le monde, cette carence sévit dans des régions dénutries où le régime alimentaire est à base de riz blanc non enrichi (extrême orient, Inde), elle est moins fréquente en Amérique et Afrique tropicales. Dans le Pacifique, le béribéri s'observait encore à la fin du XXe siècle dans l'île de Nauru[21].
Les simples déficits (insuffisance par rapport aux recommandations) sont plus fréquents mais plus difficiles à évaluer en ce qui concerne leur importance et leurs conséquences[14],[22]. En France, selon une étude réalisée dans le Val-de-Marne en 1994, près de 8 % des enfants et adolescents, et 16 % des adultes seraient concernés[14],[23].
Populations à risque
La carence en thiamine peut résulter[11],[14]:
- d'un défaut d'apport : anorexie, alcoolisme chronique, consommation exclusive de riz poli et d'aliments riches en thiaminases (poissons crus).
- d'une malabsorption intestinale : alcoolisme chronique, résection de l'intestin grêle, chirurgie bariatrique, carence en folates.
- d'une augmentation des besoins : par augmentation de l'anabolisme (grossesse, allaitement, enfance, adolescence) ou du catabolisme (activité physique intense, hyperthermie, hyperthyroïdie, états infectieux, traumatismes et interventions chirurgicales).
- d'une augmentation des pertes : vomissements de la grossesse, diarrhée chronique, patients en dialyse, traitement diurétique au long cours.
- d'une maladie génétique affectant le métabolisme de la thiamine comme l'anémie mégaloblastique thiamine-sensible, la maladie du sirop d'érable, la microcéphalie létale type Amish (en).
Manifestations cliniques
Les premières manifestations sont peu spécifiques (amaigrissement, anorexie, dépression, fatigue, insomnie, irritabilité) après un déficit d'environ trois semaines. Ces troubles sont précédés par des signes biologiques détectables vers le dixième jour[14].
Les signes cliniques caractéristiques surviennent au bout d'un mois, ils sont neurologiques ou cardiaques et s'aggravent progressivement[14].
Les troubles neurologiques sont ceux d'une neuropathie périphérique ou d'une encéphalopathie de Gayet-Wernicke évoluant vers un syndrome de Korsakoff. Les manifestations cardiaques sont celles d'une insuffisance cardiaque. L'ensemble peut constituer un béribéri, soit à prédominance neurologique (béribéri « sec ») d'évolution lente, soit à prédominance cardiaque (béribéri « humide ») d'évolution rapide[10],[21].
Diagnostic biologique
L'évaluation biologique se fait en principe par deux tests biologiques[14], mais d'intérêt limité en pratique car reflétant mal le statut réel en thiamine[10].
- le dosage du TPP (pyrophosphate de thiamine) dans le sang total ou les érythrocytes : un taux de 60-80 ng/mL suggère un déficit, et inférieur à 60 un état de carence.
- le dosage de l'activité d'une enzyme érythrocytaire vitamine B1- dépendante, la transcétolase. Cette activité se mesure par un coefficient dit α-ETK .
Le dosage urinaire de la thiamine évalue l'apport alimentaire en thiamine. Chez l'adulte une excrétion urinaire de moins de 100 microgrammes/jour suggère un apport inadéquat, et de moins de 40 une situation de déficit[10].
Utilisations thérapeutiques

La vitamine B1 par voie orale (chlorhydrate de thiamine, mononitrate de thiamine) fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en juillet 2023)[24].
En traitement curatif, la thiamine s'administre sous la forme de chlorhydrate de thiamine par voie parentérale pour traiter la polynévrite carentielle et l'encéphalopathie de Gayet-Wernicke. Dans l'alcoolisme chronique, les carences vitaminiques sont multiples, et il faut associer les vitamines PP, B6, B9 et B12. La thiamine injectable est aussi utilisée après chirurgie bariatrique, et en cas de vomissements gravidiques[11],[14].
La thiamine est un moyen préventif chez des patients à risque élevé de déficit : diabète, insuffisance cardiaque, HIV, Alzheimer[11].
La vitamine B1 est citée comme pouvant empêcher les piqûres de moustiques, mais cela n'a pas été établi scientifiquement, au contraire[25].
Toxicité
Chez les souris de laboratoire, la LD50 du chlorhydrate de thiamine se situe entre 3 et 15 g par kg de poids[11].
La toxicité de la thiamine est nulle ou très faible par voie orale, car si les reins fonctionnent bien, l'excès de thiamine est immédiatement excrété par les urines. Chez les humains, la thiamine peut être administrée par voie orale de façon prolongée, sans effets secondaires, à des doses quotidiennes de plusieurs centaines de milligrammes[11].
En revanche, son administration par voie parentérale peut causer des accidents allergiques (sensation de chaleur, urticaire…), voire un choc anaphylactique dit choc thiaminique. Ce dernier accident, très rare mais très grave, peut survenir à des doses supérieures à 100-300 mg par jour et plus souvent au delà de 500 mg par jour, lors d'injection intraveineuse[11].
L'administration de thiamine doit être prudente en cas d'insuffisance rénale ou d'antécédents allergiques[11].
Synthèse chimique
La thiamine est largement répandue dans les produits naturels, mais en trop faible quantité pour rentabiliser une extraction à partir de sources naturelles. Dès lors la thiamine est produite par chimie de synthèse[11].
Il existe plusieurs voies de synthèse pour la vitamine B1. La première synthèse totale date de 1936.
Synthèse en laboratoire
Dans la première synthèse totale proposée pour la thiamine en 1936, du 3-éthoxypropanoate d'éthyle est traité avec du formiate d'éthyle pour donner comme intermédiaire réactionnel un composé dicarbonylé qui, lorsqu'il réagit avec de l'acétamidine (la plus simple des amidines), forme une pyrimidine substituée. La conversion de son groupe hydroxyle vers un groupe amino se fait par substitution nucléophile aromatique, d'abord vers le dérivé chloré en utilisant de l'oxychlorure de phosphore, suivi d'un traitement à l'ammoniaque. Le groupe éthoxy est alors converti en dérivé bromé par de l'acide bromhydrique. Dans la dernière étape, la thiamine (sous forme de dibromure) se forme par une réaction d'alkylation utilisant du 4-méthyl-5-(2-hydroxyéthyl)thiazole[26],[27].
Synthèse industrielle

Merck & Co. adapte en 1936 à l'échelle industrielle la synthèse en laboratoire. Ils peuvent ainsi synthétiser la thiamine à Rahway an 1937[27]. Une voie de synthèse alternative est cependant découverte[28] dès 1937, utilisant de la diamine de Grewe (c'est-à-dire de la 4-amino-2-méthyl-5-pyrimidineméthanamine). Hoffman-La Roche étudie cette synthèse et des procédés de fabrication compétitifs voient le jour. L'optimisation de cette synthèse par divers procédés reste d'intérêt[27],[29].
Dans l'espace économique européen, la thiamine est enregistrée selon le règlement REACH et entre 100 et 1000 tonnes en sont produites ou importées annuellement[30].
Dans le monde animal
La vitamine B1 est nécessaire à la plupart des êtres vivants, et un déficit en thiamine a été signalé dans de nombreuses espèces animales domestiques, mais aussi sauvages : chez les mammifères (renard argenté) , les oiseaux (mouette, eider), reptiles (alligator), poissons (saumon, truite, anguilles), et même la moule commune[31],[32].

Ce déficit en thiamine est en augmentation dans le monde animal, y compris la vie sauvage, mais cela ne se traduit pas par une augmentation chez les humains. Chez l'animal, les principales causes seraient les modifications environnementales et le changement climatique qui rend la thiamine moins disponible, ainsi qu'une alimentation inadéquate : par exemple dans la région des Grands lacs, les truites et saumons qui ont pour proie des gaspareaux, une espèce invasive de petits poissons dont la chair est riche en thiaminases[31],[32].
Chez les ruminants, toutes les vitamines B sont synthétisées par les microbiotes du rumen [33]: pour la thiamine 90 % est synthétisée par ces microbiotes, 10 % provient des aliments[34]. En principe, les ruminants n'ont pas besoin que les vitamines B soient apportées par l'alimentation[33]. Cependant ces microbiotes peuvent être perturbés par un déséquilibre tel que l'acidose ruminale[35], avec un risque de déficit en thiamine[34].
Chez la vache laitière, cette acidose ruminale peut être provoquée par des aliments hautement concentrés pour une plus grande production de lait (qui ne peut pas être obtenue par le fourrage habituel)[35]. Ces animaux peuvent souffrir de divers troubles métaboliques et lésions inflammatoires, susceptibles d'être prévenus par une supplémentation en thiamine ou vitamine B1[34],[35].



