Succinyl-coenzyme A synthétase
La succinyl-CoA synthétase (SCS), également appelée succinate thiokinase et succinate-CoA ligase, est une ligase qui catalyse la réaction :
| Succinyl-coenzyme A synthétase à GTP | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Succinate-CoA Ligase (GTP) | |
| Symbole | SUCLG | |
| N° EC | 6.2.1.4 | |
| Gène SUCLG1 – Sous-unités α | ||
| Homo sapiens | ||
| Locus | 2p11.2 | |
| Masse moléculaire | 36 250 Da[1] | |
| Nombre de résidus | 346 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Gène SUCLG2 – Sous-unités β | ||
| Homo sapiens | ||
| Locus | 3p14.1 | |
| Masse moléculaire | 46 511 Da[1] | |
| Nombre de résidus | 432 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
| Succinyl-coenzyme A synthétase à ATP | ||
| Caractéristiques générales | ||
| Nom approuvé | Succinate-CoA Ligase (ATP) | |
| Symbole | SUCLA | |
| N° EC | 6.2.1.5 | |
| Homo sapiens | ||
| Locus | 13q14.2 | |
| Masse moléculaire | 50 317 Da[1] | |
| Nombre de résidus | 463 acides aminés[1] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
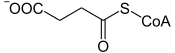 | + GDP / ADP + Pi GTP / ATP + CoA + | |
| Succinyl-CoA | Succinate |
Cette enzyme de la matrice mitochondriale des eucaryotes catalyse la seule phosphorylation au niveau du substrat du cycle de Krebs. Elle réalise le couplage d'une réaction exergonique, l'hydrolyse de la Succinyl-CoA en succinate, avec la phosphorylation de l'ADP ou du GDP en ATP ou en GTP respectivement, qui est une réaction endergonique. La variation d'enthalpie libre standard résultante de cette réaction vaut ΔG°’ = −3,4 kJ·mol-1.
Il existe deux isoformes de cette enzyme, spécialisées chacune pour un nucléoside triphosphate particulier :
- la succinate-CoA ligase formant du GDP (EC ) fonctionne avec le couple GDP / GTP ;
- la succinate-CoA ligase formant de l'ADP (EC ) fonctionne avec le couple ADP / ATP.
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| N° EC | EC |
|---|---|
| N° CAS |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Structure et mécanisme
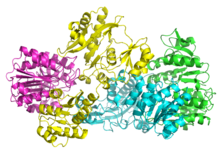
Les succinyl-CoA synthétases de bactéries et de mammifères sont constituées de sous-unités α et β[4]. Chez Escherichia coli, deux hétérodimères αβ s'assemblent pour former une structure hétérotétramérique α2β2, tandis que les enzymes mitochondriales de mammifères sont actives comme simples hétérodimères αβ et ne forment pas d'hétérotétramères[5].
La structure tétramérique bactérienne a été cristallisée et caractérisée de manière très détaillée[5],[6]. Comme le montre l'image ci-dessous, les deux sous-unités α se trouvent de chaque côté de la structure tandis que les deux sous-unités β interagissent dans les régions centrales de la protéine. Dans cette configuration, chaque sous-unité α interagit avec une sous-unité β tandis que chaque sous-unité β interagit avec l'autre sous-unité β et l'une des deux sous-unités α[5].

La structure cristallisée de la sous-unité α de la succinyl-CoA synthétase a été déterminée à une résolution de 0,21 nm (PDB 1CQJ[7]).
La coenzyme A se lie dans un pli Rossmann à l'intérieur des sous-unités α à proximité du résidu His246α[5]. Ce résidu est phosphorylé au cours de la réaction. On a ainsi pu montrer qu'un antibiotique qui bloque la phosphorylation des résidus d'histidine agit également comme inhibiteur puissant de la succinyl-CoA synthétase bactérienne[8].
Le site de liaison du succinate n'est pas connu avec précision[9].

La formation du nucléoside triphosphate se produit dans un domaine de liaison à l'ATP, situé à proximité de l'extrémité N-terminale de chaque sous-unité β. Ce domaine de liaison à l'ATP est cependant distant d'environ 3,5 nm du résidu d'histidine phosphorylé[7]. Ceci laisse penser que l'enzyme subit une modification conformationnelle importante pour amener ce résidu d'histidine à proximité du site de liaison à l'ATP et permettre la formation du nucléoside triphosphate. Des expériences par mutagenèse ont établi que deux résidus de glutamate — le Glu208α à proximité de l'His246α et le Glu197β à proximité du site de liaison à l'ATP — jouent un rôle dans la phosphorylation et la déphosphorylation de l'histidine, mais le mécanisme exact de ces modifications conformationnelles n'est pas entièrement compris[9].
Fonctions et régulation
La succinyl-CoA synthétase est la seule enzyme du cycle de Krebs qui catalyse une phosphorylation au niveau du substrat. Les enzymes d'E. coli phosphorylent aussi bien le GDP que l'ADP[6]. En revanche, les mammifères possèdent plusieurs types de succinyl-CoA synthétases, chacune étant spécifique pour le GDP (isoforme G-SCS) ou pour l'ADP (isoforme A-SCS). Ces isoformes sont exprimées chacune dans des tissus spécifiques. Par exemple, on a pu montrer que, chez les pigeons, les G-SCS sont exprimées dans les hépatocytes (cellules du foie) tandis que les A-SCS sont exprimées dans les myocytes (cellules musculaires) pectoraux[10]. D'autres études ont mis en évidence des caractéristiques semblables chez le rat, la souris, et chez l'homme : il apparaît ainsi que les tissus intervenant essentiellement dans l'anabolisme, tels que le foie et les reins, tendent plutôt à exprimer la G-SCS, tandis que les tissus intervenant essentiellement dans le catabolisme, tels que le cerveau, le cœur et les muscles, tendent plutôt à exprimer l'A-SCS[11].
La succinyl-CoA synthétase facilite les flux de molécules vers d'autres voies métaboliques en contrôlant les interconversions entre la succinyl-CoA et le succinate[12]. Cette fonction est importante dans la mesure où la succinyl-CoA est un intermédiaire indispensable à la biosynthèse de la porphyrine, de l'hème[13] et des corps cétoniques[14].
Cette enzyme est régulée au niveau de sa transcription[15]. On a pu montrer que le gène sucCD, qui encode cette protéine, est transcrit en même temps que le gène sucAB encodant le complexe α-cétoglutarate déshydrogénase, sous le contrôle d'un promoteur, appelé sdhC, qui appartient à l'opéron succinate déshydrogénase. Cet opéron est activé en présence d'oxygène et répond à un grand nombre de sources carbonées.