Lipopolysaccharide
Les lipopolysaccharides (LPS), également appelés lipoglycanes ou endotoxines, sont de grosses molécules constituées d’un lipide et d’un polysaccharide composé d’un antigène O, d’un noyau externe et d’un noyau interne reliés par une liaison covalente. Ils se trouvent dans la membrane externe des bactéries à Gram négatif.


Le lipopolysaccharide (LPS) se lie au récepteur TLR4 et promeut la libération de cytokines pro-inflammatoires. C'est une endotoxine pyrogène. Il induit chez l'homme des signes cliniques (fièvre, agrégation des hématies, choc septique, diminution de la pression artérielle). C'est la partie lipide A qui est considérée comme la plus toxique (action sur les granulocytes et les cellules épithéliales).
En recherche fondamentale, le LPS est souvent utilisé pour provoquer l'inflammation tel que l'induction de la cyclooxygénase-2 sur des cellules ou des organes en culture. Généralement il est utilisé à une concentration de 100 mg/L.
Découverte
L’activité toxique du LPS a été découverte et appelée "endotoxine" par Richard Pfeiffer. Il a distingué les exotoxines, qu’il a classées comme toxines libérées par la bactérie dans l’environnement, et les endotoxines, qu’il a considérées conservées "à l'intérieur" de la cellule bactérienne et libérées uniquement après la destruction de la paroi cellulaire bactérienne[1]. Des travaux ultérieurs ont cependant montré que la libération de LPS de microbes Gram négatifs ne requiert pas nécessairement la destruction de la paroi cellulaire bactérienne. En effet, le LPS peut être sécrété durant l'activité physiologique normale liée au trafic des vésicules de membrane. Le LPS est alors relâché par la bactérie sous la forme de vésicules de membrane externe. Ces vésicules membranaires peuvent également contenir d’autres facteurs de virulence et des protéines[2].
Aujourd'hui, le terme « endotoxine » est surtout utilisé comme synonyme de LPS[3] bien qu'il existe quelques endotoxines qui ne sont pas liées au LPS, telles que les protéines dites endotoxines delta sécrétées par Bacillus thuringiensis.
Fonctions dans les bactéries
Le LPS est le composant majeur de la membrane externe des bactéries à Gram négatif. Il contribue grandement à l’intégrité structurelle de la bactérie et protège la membrane de certains types d’attaques chimiques. Le LPS augmente également la charge négative de la membrane cellulaire et aide à stabiliser la structure globale de la membrane. Il est d'une importance cruciale pour de nombreuses bactéries à Gram négatif, qui meurent si le LPS est muté ou supprimé. Cependant, il semble que le LPS soit non essentiel chez au moins certaines bactéries à Gram négatif, telles que Neisseria meningitidis, Moraxella catarrhalis et Acinetobacter baumannii[4]. Le LPS induit une forte réponse du système immunitaire chez l'animal. Il est également impliqué dans des aspects non pathogènes de l'écologie bactérienne, notamment l'adhésion de surface, la sensibilité aux bactériophages et les interactions avec des prédateurs comme les amibes.
Le LPS est nécessaire pour la conformation correcte de l'activité de l'omptine; cependant, les LPS lisses entraveront stériquement les omptines.
Composition
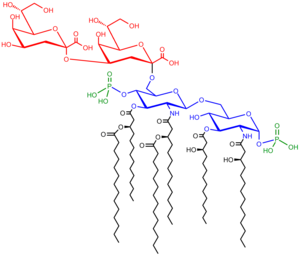
Le lipopolysaccharide (LPS) comprend trois parties:
- Antigène O (ou polysaccharide O)
- Core oligosaccharide
- Lipide A
Antigène-O
L'antigène O est spécifique d'une espèce à une autre. Il est composé de deux triosides et d'un dioside. C'est un groupement qui se répète de 2 à 40 fois. Les chaînes latérales ont une structure qui confère la spécificité antigénique. Lors du passage à l'état R (rough) des colonies, ce sont ces chaînes latérales qui sont perdues. Il permet le sérogroupage, étape essentielle dans l'identification des Enterobacteriaceae, notamment des Salmonella. Certaines bactéries comme Haemophilus influenzae ne possèdent pas de tel antigène.
Un polymère de glycane répétitif contenu dans un LPS est appelé antigène O, polysaccharide O ou chaîne latérale O de la bactérie. L'antigène O est lié à l'oligosaccharide central et comprend le domaine le plus externe de la molécule de LPS. La composition de la chaîne O varie d'une souche à l'autre. Par exemple, il existe plus de 160 structures d'antigènes O différentes produites par différentes souches d'Escherichia coli[5]. La présence ou l'absence de chaînes en O détermine si le LPS est considéré comme rugueux ou lisse. Les chaînes O pleine longueur rendraient le LPS lisse, tandis que l'absence ou la réduction des chaînes O rendrait le LPS rugueux[6]. Les bactéries présentant un LPS brut ont généralement des membranes cellulaires plus pénétrables par un antibiotique hydrophobe, puisqu'un LPS brut est plus hydrophobe[7]. L'antigène O est exposé à la surface même de la cellule bactérienne et constitue par conséquent une cible pour la reconnaissance par les anticorps de l'hôte.
Core
Le domaine Core contient toujours un composant oligosaccharide qui se lie directement au lipide A et contient généralement des sucres tels que l'heptose et l'acide 3-désoxy-D-manno-oct-2-ulosonique (également appelé KDO, céto-désoxyoctulosonate)[8]. Les noyaux LPS de nombreuses bactéries contiennent également des composants non glucidiques, tels que des substituants phosphate, acides aminés et éthanolamine.
Lipide A
Le lipide A est, dans des circonstances normales, un disaccharide phosphorylé de glucosamine décoré de multiples acides gras. Ces chaînes d'acide gras hydrophobes ancrent le LPS dans la membrane bactérienne et le reste du LPS dépasse de la surface de la cellule. Le domaine lipidique A est responsable d’une grande partie de la toxicité des bactéries à Gram négatif. Lorsque les cellules bactériennes sont lysées par le système immunitaire, des fragments de membrane contenant le lipide A sont libérés dans la circulation, provoquant fièvre, diarrhée et éventuellement un choc endotoxique fatal (également appelé choc septique). Le fragment Lipide A est un composant très conservé du LPS[9]. Cependant, la structure du lipide A varie selon les espèces bactériennes et définit une activation immunitaire globale de l'hôte[10].
Lipo-oligosaccharides
Les lipo-oligosaccharides (LOS) sont des glycolipides présents dans la membrane externe de certains types de bactéries à Gram négatif, telles que Neisseria spp. et Haemophilus spp. Le terme est synonyme de la forme de bas poids moléculaire de LPS bactérien[11]. Le LOS joue un rôle central dans le maintien de l'intégrité et de la fonctionnalité de la membrane externe de l'enveloppe de la cellule à Gram négatif. Les lipo-oligosaccharides jouent un rôle important dans la pathogenèse de certaines infections bactériennes, car ils peuvent agir comme immunostimulateurs et immunomodulateurs[11]. De plus, les molécules LOS sont responsables de la capacité de certaines souches bactériennes à présenter un mimétisme moléculaire et une diversité antigénique, permettant d'échapper aux défenses immunitaires de l'hôte et contribuant ainsi à la virulence de ces souches bactériennes.
Chimiquement, les lipo-oligosaccharides sont dépourvus d’antigènes O et ne possèdent qu’un fragment d’ancrage à la membrane externe à base de lipide A et un noyau oligosaccharidique[12]. Dans le cas de Neisseria meningitidis, le lipide A de la molécule a une structure symétrique et le noyau interne est composé de résidus acide 3-désoxy-D-manno-2-octulosonique (KDO) et heptose (Hep). La chaîne oligosaccharidique du noyau externe varie en fonction de la souche bactérienne[11],[12]. Le terme lipo-oligosaccharide est utilisé pour désigner la forme à bas poids moléculaire des lipopolysaccharides bactériens, qui peuvent être classés en deux formes: la forme à poids moléculaire élevé (Mr ou lisse) possède une chaîne O de polysaccharide répétée de poids moléculaire élevé, alors que la forme de bas poids moléculaire (faible Mr ou rugueux), n'a pas la chaîne O mais possède un oligosaccharide court à la place[11].
Modifications du LPS
La fabrication du LPS peut être modifiée afin de présenter une structure de sucre spécifique. Celles-ci peuvent être reconnues soit par d'autres LPS (qui permettent d'inhiber les toxines du LPS), soit par des glycosyl-transférases qui utilisent cette structure de sucre pour ajouter des sucres plus spécifiques. Il a été démontré qu’une enzyme spécifique dans l’intestin (phosphatase alcaline) peut détoxifier le LPS en éliminant les deux groupes phosphates présents dans les glucides du LPS[13]. Cela peut servir de mécanisme d'adaptation pour aider l'hôte à gérer les effets potentiellement toxiques des bactéries à Gram négatif normalement présentes dans l'intestin grêle. Une enzyme différente peut détoxifier le LPS lorsqu’il entre ou est produit dans les tissus animaux. Les neutrophiles, les macrophages et les cellules dendritiques produisent une lipase, l’acyloxyacyl hydrolase (AOAH), qui inactive le LPS en éliminant les deux chaînes acyle secondaires du lipide A. Si elles reçoivent du LPS par voie orale, les souris sans AOAH développent des titres élevés d’anticorps non spécifiques, développent une hépatomégalie prolongée et ont une tolérance prolongée aux endotoxines. Il peut être nécessaire d'inactiver les LPS pour que les animaux retrouvent l'homéostasie après une exposition parentérale aux LPS[14].
Biosynthèse et transport
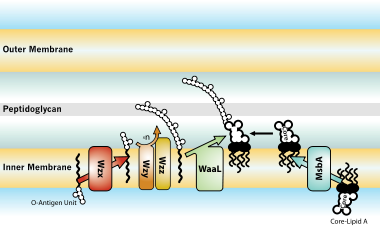

Effets biologiques sur les hôtes infectés par des bactéries à Gram négatif
Réponse immunitaire
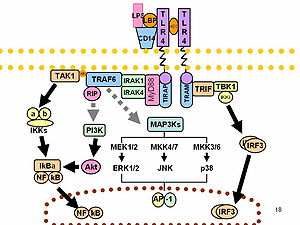
Le LPS agit comme endotoxine prototypique car il se lie au complexe récepteur CD14/TLR4/MD2 dans de nombreux types de cellules, mais en particulier dans les monocytes, les cellules dendritiques, les macrophages et les cellules B, ce qui favorise la sécrétion de cytokines pro-inflammatoires, d'oxyde nitrique et d'icosanoïdes[17].
Dans le cadre de la réponse au stress cellulaire, le superoxyde est l’une des principales espèces d’oxygène réactif induites par le LPS dans divers types de cellules exprimant le TLR (récepteur de type Toll).
Le LPS est également un pyrogène exogène (substance induisant de la fièvre).
Étant d'une importance cruciale pour les bactéries à Gram négatif, ces molécules constituent des cibles potentielles pour de nouveaux agents antimicrobiens.
Certains chercheurs ont des doutes sur les effets toxiques généralisés attribués à tous les lipopolysaccharides, en particulier aux cyanobactéries[18].
La fonction du LPS fait l'objet de recherches expérimentales depuis plusieurs années en raison de son rôle dans l'activation de nombreux facteurs de transcription. Le LPS produit également de nombreux types de médiateurs impliqués dans le choc septique. Les humains sont beaucoup plus sensibles au LPS que les autres animaux (par exemple, les souris). Une dose de 1 µg/kg induit un choc chez l'homme, mais les souris toléreront une dose mille fois plus élevée[19]. Cela peut être lié aux différences de taux d'anticorps naturels en circulation entre les deux espèces[20],[21]. Said et al. ont montré que le LPS provoque une inhibition de l'expansion et de la fonction des cellules T CD4 dépendante de l' IL-10 en régulant positivement les taux de PD-1 sur les monocytes, ce qui conduit à la production d'IL-10 par les monocytes après liaison de PD-1 par PD-L1[22].
Les endotoxines sont en grande partie responsables des manifestations cliniques dramatiques d'infections par des bactéries pathogènes à Gram négatif, telles que Neisseria meningitidis, les agents pathogènes responsables de la méningococcie, notamment la méningococcémie, le syndrome de Waterhouse – Friderichsen et la méningite.
Bruce Beutler a reçu une partie du prix Nobel de physiologie ou de médecine 2011 pour ses travaux démontrant que TLR4 est le récepteur du LPS[23],[24].
Des portions du LPS provenant de plusieurs souches bactériennes se sont révélées chimiquement similaires aux molécules de la surface des cellules hôtes humaines. La capacité de certaines bactéries à présenter à leur surface des molécules chimiquement identiques ou similaires aux molécules de surface de certains types de cellules hôtes est appelée mimétisme moléculaire[25]. Par exemple, dans Neisseria meningitidis L2,3,5,7,9, la partie tétrasaccharide terminale de l'oligosaccharide (lacto-N-néotétraose) est le même tétrasaccharide que celui trouvé dans le paragloboside , un précurseur des antigènes glycolipidiques ABH trouvés sur les érythrocytes humains[11]. Dans un autre exemple, la partie trisaccharide terminale (lactotriaose) de l'oligosaccharide provenant de Neisseria spp. le LOS est également présent dans les glycosphingolipides lactonéoséries de cellules humaines[11]. La plupart des méningocoques des groupes B et C, ainsi que des gonocoques, se sont avérés avoir ce trisaccharide dans leur structure LOS[11]. La présence de ces "imitateurs" de la surface des cellules humaines peut, outre agir comme un "camouflage" du système immunitaire, jouer un rôle dans l'abolition de la tolérance immunitaire lors de l'infection d'hôtes par certains génotypes de l'antigène leucocytaire humain (HLA), tels que HLA-B35[11].
Récemment, une nouvelle étude publiée a révélé que les cellules souches hématopoïétiques (CSH) peuvent être détectées directement par la liaison avec TLR4, les faisant proliférer en réaction à une infection systémique. Cette réponse active la signalisation TLR4-TRIF-ROS-p38 au sein des CSH et, par une activation prolongée du TLR4, peut provoquer un stress prolifératif entraînant une altération de leur capacité de repeuplement compétitif[26]. L'infection chez les souris par S. typhimurium a donné des résultats similaires, validant également le modèle expérimental in vivo.
Effet de la variabilité sur la réponse immunitaire
Les antigènes 0 (les glucides extérieurs) constituent la partie la plus variable de la molécule de LPS, conférant la spécificité antigénique. En revanche, le lipide A est la partie la plus conservée. Cependant, la composition du lipide A peut également varier (par exemple, le nombre et la nature des chaînes acyle même au sein des genres ou entre ceux-ci). Certaines de ces variations peuvent conférer des propriétés antagonistes à ces LPS. Par exemple, le lipide A de Rhodobacter sphaeroides diphosphoryl (RsDPLA) est un antagoniste puissant du LPS dans les cellules humaines, mais est un agoniste dans les cellules de hamster et d'équin. On a supposé que les lipides A coniques (provenant par exemple de E. coli) sont plus agonistes, moins lipidiques A coniques que ceux de Porphyromonas gingivalis pouvant activer un signal différent (TLR2 au lieu de TLR4) et complètement cylindriques comme ceux de Rhodobacter sphaeroides est antagoniste aux TLR[27],[28].
Les clusters de gènes de LPS varient grandement entre les différentes souches, sous-espèces, espèces d'agents pathogènes bactériens des plantes et des animaux[29],[30].
Le sérum de sang humain normal contient des anticorps anti-LOS bactéricides et les patients atteints d'infections causées par des souches sérotypiquement distinctes possèdent des anticorps anti-LOS qui diffèrent par leur spécificité par rapport au sérum normal[31]. Ces différences de réponse immunitaire humorale à différents types de LOS peuvent être attribuées à la structure de la molécule de LOS, principalement dans la structure de la partie oligosaccharide de la molécule de LOS[31]. Chez Neisseria gonorrhoeae, il a été démontré que l'antigénicité des molécules de LOS peut changer au cours d'une infection en raison de la capacité de ces bactéries à synthétiser plus d'un type de LOS[31], caractéristique connue sous le nom de variation de phase. De plus, Neisseria gonorrhoeae, ainsi que Neisseria meningitidis et Haemophilus influenzae[11], sont capables de modifier encore plus leur LOS in vitro, par exemple par la sialylation (modification avec des résidus d’acide sialique) et d’augmenter leur résistance à la destruction à médiation par le complément[31] ou même la régulation à la baisse de l'activation du complément[11] ou éluder les effets des anticorps bactéricides[11]. La sialylation peut également contribuer à entraver l'attachement des neutrophiles et la phagocytose par les cellules du système immunitaire ainsi qu'une réduction de l'éclatement par oxydation[11]. Haemophilus somnus, un agent pathogène du bétail, a également montré une variation de phase de LOS, caractéristique qui pourrait contribuer à l'évasion des défenses immunitaires de l'hôte bovin[32]. Prises ensemble, ces observations suggèrent que les variations dans les molécules de surface bactériennes telles que la LOS peuvent aider le pathogène à échapper à la fois aux défenses immunitaires humorales (médiées par le complément et les anticorps) et à la médiation cellulaire (neutrophiles, par exemple).
Voies non canoniques de reconnaissance du LPS
Récemment, il a été démontré que certains membres de la famille des canaux ioniques potentiels des récepteurs transitoires, en plus des voies médiées par TLR4, reconnaissent le LPS[33]. L'activation de TRPA1 par les LPS a été démontrée chez des souris[34] et des mouches Drosophila melanogaster[35]. À des concentrations plus élevées, le LPS active également d'autres membres de la famille de canaux sensoriels TRP, tels que TRPV1, TRPM3 et dans une certaine mesure[36] TRPM8. Le LPS est reconnu par TRPV4 sur les cellules épithéliales. L'activation de TRPV4 par le LPS était nécessaire et suffisante pour induire une production d'oxyde nitrique ayant un effet bactéricide[37].
Effets sur la santé
Endotoxémie
La présence d'endotoxines dans le sang s'appelle endotoxémie. Cela peut entraîner un choc septique si la réponse immunitaire est très importante[38].
En outre, les endotoxémies d'origine intestinale, en particulier à l' interface hôte-pathogène , sont considérées comme un facteur important du développement de l'hépatite alcoolique[39] susceptible de se développer lors de la colonisation bactérienne chronique de l'intestin grêle et de l'augmentation de la perméabilité intestinale qui en découle[40].
Le lipide A peut provoquer une activation incontrôlée du système immunitaire des mammifères et la production de médiateurs inflammatoires pouvant entraîner un choc septique[12]. Cette réaction inflammatoire est médiée par le récepteur de type Toll 4 (TLR4) qui est responsable de l'activation des cellules du système immunitaire[12]. Les lésions de la couche endothéliale des vaisseaux sanguins causées par ces médiateurs inflammatoires peuvent entraîner un syndrome de fuite capillaire, une dilatation des vaisseaux sanguins et une diminution de la fonction cardiaque ainsi qu'un choc septique[41]. Une importante activation du complément peut également être observée plus tard au cours de la multiplication des bactéries dans le sang[41]. Une prolifération bactérienne importante provoquant des lésions endothéliales destructrices peut également conduire à une coagulation intravasculaire disséminée avec perte de la fonction de certains organes internes tels que les reins, les glandes surrénales et les poumons en raison d'un apport sanguin compromis. La peau peut montrer les effets des dommages vasculaires souvent associés à une diminution des facteurs de coagulation sous la forme de pétéchies, de purpura et d'ecchymoses. Les membres peuvent également être touchés, parfois avec des conséquences dévastatrices telles que le développement de la gangrène, nécessitant une amputation ultérieure[41]. La perte de fonction des glandes surrénales peut provoquer une insuffisance surrénale et une hémorragie supplémentaire des surrénales provoque le syndrome de Waterhouse-Friderichsen, qui peuvent tous les deux mettre la vie en danger. Il a également été rapporté que le LOS gonococcique peut causer des lésions aux trompes de Fallope humaines[31].
Maladies auto-immunes
On pense que le mimétisme moléculaire de certaines molécules de LOS provoque des réponses auto-immunes, telles que des poussées de sclérose en plaques[11],[25]. D'autres exemples de mimétisme bactérien des structures de l'hôte via le LOS sont trouvés avec les bactéries Helicobacter pylori et Campylobacter jejuni, des organismes qui causent des maladies gastro-intestinales chez l'homme, et Haemophilus ducreyi qui cause le chancre. Certains sérotypes de LPS de C. jejuni (attribués à certaines fractions tétra et pentasaccharides de l'oligosaccharide central) ont également été impliqués dans le syndrome de Guillain–Barré et une de ses variantes appelée syndrome de Miller-Fisher[11].
Lien avec l'obésité
Des études épidémiologiques ont précédemment montré qu'une augmentation de la charge en endotoxines, pouvant résulter d'une augmentation du nombre de bactéries productrices d'endotoxines dans le tractus intestinal, est associée à certains groupes de patients liés à l'obésité[42],[43],[44]. D'autres études ont montré que les endotoxines purifiées d'Escherichia coli peuvent induire l'obésité et la résistance à l'insuline lorsqu'elles sont injectées à des modèles de souris sans germes[45]. Une étude plus récente a révélé que Enterobacter cloacae B29 pouvait contribuer à l’obésité et à la résistance à l’insuline chez les patients humains[46]. Le mécanisme présumé pour l'association endotoxine-obésité est que l'endotoxine induit une voie médiée par l'inflammation rendant compte de l'obésité et de la résistance à l'insuline observées[45]. Il existe une corrélation entre le LPS plasmatique et la résistance à l'insuline[47].
Escherichia, Enterobacter sont des genres bactériens associés à des problèmes d'obésité liés aux endotoxines.
Recherche en laboratoire et systèmes de production biotechnologique
Les lipopolysaccharides sont des contaminants fréquents dans l'ADN plasmidique préparé à partir de bactéries ou de protéines exprimées à partir de bactéries. Ils doivent être éliminés de l'ADN ou des protéines pour éviter la contamination des expériences et la toxicité des produits fabriqués par fermentation industrielle[48].
En outre, l'ovalbumine est fréquemment contaminée par des endotoxines. L’ovalbumine est l’une des protéines les plus étudiées dans les modèles animaux et un allergène bien établi pour l’hyper-réactivité des voies respiratoires. L’ovalbumine disponible dans le commerce et contaminée par le LPS peut complètement activer les cellules endothéliales lors d’une analyse in vitro de la première étape de l’inflammation. Elle fausse les résultats de la recherche car elle ne reflète pas avec précision l’effet de l’antigène protéique unique sur la physiologie animale.
En production pharmaceutique, il est nécessaire d’éliminer toutes les traces d’endotoxines des récipients de médicaments, car même de petites quantités d’endotoxines peuvent provoquer des maladies chez l’homme. Un four de dépyrogénation est utilisé à cet effet. Des températures supérieures à 300 °C sont nécessaires pour décomposer cette substance. Un taux défini de réduction des endotoxines est la corrélation entre le temps et la température. Sur la base des matériaux d’emballage des seringues ou des flacons, une température du verre de 250 °C et une durée de 30 minutes sont généralement nécessaires pour obtenir la réduction du taux d'endotoxines par un facteur de 1000[49].
La norme du dosage pour détecter la présence de l'endotoxine est le Limulus Amebocyte Lysate dosage (LAL), utilisant le sang de la limule (Limulus polyphemus)[50]. De très faibles niveaux de LPS peuvent provoquer la coagulation du lysat de limule en raison d'une puissante amplification via une cascade enzymatique. Cependant, en raison de la diminution de la population de limules et de l'existence de facteurs interférant avec le test LAL, des efforts ont été réalisés pour développer des analyses alternatives, dont les plus prometteuses sont des tests ELISA utilisant une version recombinante d'une protéine dans le test LAL, le Facteur C[51].
Dans le test d'Ames, on utilise des mutants dépourvus de LPS car ils sont plus perméables aux agents mutagènes.
Voir également
Références
- (en) MeSH Lipopolysaccharides


