Biotiini
 | |
 | |
Biotiini | |
| Systemaattinen (IUPAC) nimi | |
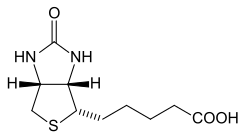
| 5-[(3aS,4S,6aR)-2-okso-1,3,3a,4,6,6a-heksahydrotieno[3,4-d]imidatsol-4-yyli]pentaanihappo | |
| Tunnisteet | |
| CAS-numero | |
| ATC-koodi | A11 |
| PubChem CID | |
| DrugBank | |
| Kemialliset tiedot | |
| Kaava | C10H16N2O3S |
| Moolimassa | 244,310 g/mol |
| Synonyymit | koentsyymi R, H-vitamiini[1] |
| Fysikaaliset tiedot | |
| Tiheys | 1,41[2] g/cm³ |
| Sulamispiste | 232 °C hajoaa sulamatta[3] |
| Liukoisuus veteen | Liukoinen[3] |
| Farmakokineettiset tiedot | |
| Hyötyosuus | 100 % nieltynä[4] |
| Proteiinisitoutuminen | 19 %[5] |
| Metabolia | ? |
| Puoliintumisaika | 7,8–18,8 tuntia[4] |
| Ekskreetio | Pääosin virtsa[5] |
| Terapeuttiset näkökohdat | |
| Raskauskategoria | N(US)[6] |
| Reseptiluokitus | |
| Antotapa | Nieltynä[6] |
Biotiini eli B7-vitamiini on ureido- ja tetrahydrotiofeenirenkaat sekä valeriaanahappohännän sisältävä orgaaninen yhdiste.[7] Se on vitamiini ihmisille ja useille muille eliöille, joiden siis tulisi saada sitä ravinnosta usein ja kylliksi.[5]
Biotiinia on kylliksi monissa ruuissa, joten sen puutos on ihmisillä harvinaista.[5] Alisaantia voi ilmetä biotiinitonta maitokorviketta saavilla vauvoilla tai aliravituilla ihmisillä. Puutokseen voivat johtaa myös ruuansulatuskanavan imeytymishäiriöt tai raakojen kananmunan valkuaisten toistuva syönti niiden biotiinin imeytymistä estävän avidiinin takia. Puutos voi olla geneettinenkin.[8]
Monet bakteerit ja jotkin kasvit, arkit ja sienet voivat valmistaa biotiinia, mutta mitkään eläinsolut eivät.[2]
Biotiini on prosteettinen ryhmä tietyissä entsyymeissä eli niihin kovalenttisesti sitoutunut ja entsyymitoiminnassa välttämätön aine. Biotiinientsyymit ovat karboksylaaseja: ne muodostavat karboksyylihapporyhmiä sopiviin aineisiin. Eräs biotiinientsyymi on glukoneogeneesin pyruvaattikarboksylaasi. Muissa entsyymeissä biotiini on myös osa rasvahappojen synteesiä, aminohappojen hajotusta ja epäsuorasti energian eli ATP:n tuottoa.[5]
Suositukset ja saanti
muokkaa wikitekstiäSuomen valtion ravitsemusneuvottelukunta ei ole esittänyt ravitsemussuosituksia biotiinille.[9]
Euroopan elintarviketurvallisuusvirasto (EFSA) ei ole esittänyt saantisuosituksia biotiinille tutkimustiedon puutteen takia. EFSA on silti antanut arvot riittävälle saannille eli AI-arvot (engl. adequate intake). Nämä ovat arvioita siitä, mikä määrä biotiinia riittää ylläpitämään jonkin väestöryhmän terveenä. Ryhmät on eritelty alla olevassa taulukossa.[10] Eräs ero todellisen vähimmäistarpeen keskiarvon ja AI-arvon välillä on se, että AI-arvon tulisi olla suurempi.[11]
| Ikä | Miehet ja naiset | Raskaana olevat |
|---|---|---|
| 7–11 kk | 6 | 40 |
| 1–3 v | 20 | |
| 4–6 v | 25 | |
| 7–10 v | 25 | Imettävät |
| 11–14 v | 35 | 45 |
| 15–17 v | 35 | |
| ≥ 18 v | 40 |
Liikasaanti
muokkaa wikitekstiäEFSA ei ole asettanut biotiinin päiväsaannille ylärajaa.[13] Biotiini on verrattain turvallinen aine. Niellyt 200 mg annokset tai verenkiertoon pistetyt 20 mg annokset eivät ole aiheuttaneet ihmisillä merkittäviä haittoja.[5] Suuret biotiiniannokset ravintolisänä (esimerkiksi yli 1 mg/vrk) voivat kuitenkin vääristää streptavidiinin ja biotiinin vuorovaikutukseen pohjautuvien laboratoriotestien tuloksia. Tulokset voivat olla liian suuria tai pieniä, ja johtaa siihen, että jokin vakava terveysongelma jää toteamatta. Vääriä tuloksia voi ilmetä esimerkiksi kilpirauhashormonien veripitoisuuksien mittauksissa. Tavallisen ruuan biotiinipitoisuudet taas eivät ole ongelma.[14][15]
Biotiinin myrkyllisyyttä kuvaava LD50-arvo on rotille suun kautta yli 354 mg/kg.[16]
Puutos
muokkaa wikitekstiäBiotiinipuutos on ihmisillä ja muilla eläimillä harvinainen tila, sillä biotiinia on kylliksi monissa ruuissa.[5] Ihmisillä puutosta on ilmennyt esimerkiksi kehitysmaiden aliravituilla lapsilla, raakoja kananmunan valkuaisia toistuvasti ja pitkään syöneillä (munissa on biotiinin imeytymistä suolistossa estävää avidiinia),[8] biotiinia sisältämätöntä äidinmaidonkorviketta saaneilla vauvoilla ja niillä, joilla suoliston imeytyminen on vakavasti häiriintynyt esimerkiksi lyhytsuolioireyhtymän takia. Tietyt epilepsialääkkeet voivat pitkäaikaiskäytössä altistaa puutokselle[17] – esimerkkejä ovat fenobarbitaali, fenytoiini ja karbamatsepiini, jotka syrjäyttävät biotiinia biotinidaasista.[8]
Puutos voi olla myös geneettinen ja johtua biotinidaasi- (EC-numero 3.5.1.12), holokarboksylaasisyntaasi- (EC 6.3.4.10) ja SMVT-proteiinien toiminnan heikentymisestä johtuen niiden geenimutaatioista. Geenit ovat vastaavasti BTD, HCS ja SMVT.[18] Biotinidaasi vapauttaa suolessa biotiinia ravintoproteiineista, joten sen toiminnan heikentyminen alentaa ravinnon pääosin proteiineihin sitoutuneen biotiinin saatavuutta. Oireet alkavat alle vuoden iässä. Hoitona toimivat yleensä biotiinilisät 5–20 mg päiväannoksin. Annostelua jatketaan loppuelämä. Holokarboksylaasisyntaasi liittää biotiinia sitä tarvitseviin karboksylaaseihin ja sen puutosta hoidetaan samoin. SMVT kuljettaa biotiinia solukalvojen läpi suolistossa ja muualla elimistössä.[8] SMVT-puutoksen hoitona voivat toimia myös suuret biotiiniannokset.[19] Puutosoireita voi ilmetä harvoin myös jonkin biotiinikarboksylaasin mutaation takia (esim. pyruvaattikarboksylaasin).[8] Tällöin oireet poikkeavat yleisestä biotiinipuutoksesta.[20]
Oireet
muokkaa wikitekstiäKeho ylläpitää biotiinin normaalipitoisuuksia keskushermostossa mahdollisimman pitkään. Siksi ravintoperäisessä biotiinipuutoksessa ensioireet eivät usein ole keskushermostollisia.[8] Ihmisillä puutosoireina ilmenee hiusten ohenemista ja vaalenemista. Kasvojen ihonalainen rasva voi jakautua epätavallisesti. Iholla voi ilmetä hilseilevää ja punertavaa ihottumaa – aluksi silmien, nenän ja suun ympärillä, josta se pitkittyneessä puutoksessa voi levitä muidenkin kehon aukkojen, kuten korvien ja sukupuolielinten lähelle. Aikuisilla voi ilmetä masennusta, väsymystä, poikkeavia ihotuntemuksia (parestesiaa), syrjään vetäytyvää käytöstä ja harhoja. Vauvoilla ilmenee lihasheikkoutta (hypotoniaa), väsymystä, henkisen kehityksen hidastumista sekä karvojen lähtöä.[17]
Biotinidaasipuutos ilmenee vauvana ja pääoireina ovat karvojen lähtö, ihottumat, asidoosi (virtsan ja veren happamoituminen), kuulo- ja näköhäiriöt. Holokarboksylaasisyntaasipuutos ilmenee varhaisemmin ja sen oireet voivat vakavissa muodoissa olla biotinidaasipuutosta pahempia, mutta lievinä lähes samoja. Oireina ovat pääosin syömisvaikeudet, paheneva enkefalopatia ja asidoosi.[19]
Puutoksissa ilmenevä asidoosi johtuu biotiinia prosteettiseksi ryhmäksi vaativan pyruvaattikarboksylaasin toiminnan vähentymisestä.[17] Entsyymi käsittelee pyruvaattia, joka tässä tilassa alkaa kertyä ja muuntuu maitohapoksi.[21] Maitohappoasidoosi on pääasiallinen hermosto-oireiden aiheuttaja. Iho-oireet taas johtuvat rasvahapposynteesin heikentymisestä, joka puolestaan johtuu asetyylikoentsyymi-A-karboksylaasien toiminnan vähentymisestä.[17]
Ruokapitoisuudet
muokkaa wikitekstiäMonissa ruoka-aineissa on pieniä määriä biotiinia. Sardiinit, kaura ja kananmuna sisältävät poikkeuksellisen paljon biotiinia. Kaikkein parhaita biotiinilähteitä ovat maksa ja hunajamehiläisten kuningatarhyytelö, jonka biotiinipitoisuus on yli 400 mikrogrammaa sataa grammaa kohden.[5][22] Ruuissa biotiini on usein sellaisenaan tai biosytiininä, joka on proteiineissa lysiinistään kiinni kovalenttisesti.[5]
Alla olevan taulukon pitoisuudet on mitattu happohydrolysoiduista ruokanäytteistä bakteerien kasvun avulla. Joissakin kokeissa taas mitataan happohydrolysoitujen näytteiden biotiinipitoisuuksia avidiinin ja HPLC:n avulla. Mikrobikokeet voivat yliarvioida biotiinipitoisuuksia suhteessa tarkempiin HPLC/avidiini-kokeisiin.[22]
| Viljat ja jauhot | Vihannekset ja juurekset | Pavut ja pähkinät | Maitotuotteet | ||||
|---|---|---|---|---|---|---|---|
| Kaakaojauhe, sokeriton | 26,8 | Bataatti | 3,5 | Kidneypapu, kuivattu | 8,1 | Camembert | 3,5 |
| Kaurahiutale | 16,8 | Chili, punainen | 84,0 | Kikherne, kuivattu | 25,5 | Cheddarjuusto | 2,5 |
| Ohraryyni | 3,6 | Herne, pakastettu | 2,5 | Maapähkinä, paahdettu | 81,0 | Goudajuusto | 1,0 |
| Perunajauho | 2,9 | Keltasipuli | 1,7 | Manteli, kuivattu | 32,9 | Jugurtti, täysrasvainen | 1,9 |
| Riisi, tumma | 3,2 | Keräkaali | 2,2 | Pistaasipähkinä, paahdettu | 27,4 | Kerma | 0,2 |
| Riisi, valkoinen | 2,0 | Kukkakaali | 10,0 | Saksanpähkinä, paahdettu | 15,5 | Maito, rasvaton, vähä- tai täysrasvainen | 2,7–3,0 |
| Vehnäjauho | 0,9–2,5 | Kurkku | 1,9 | Seesaminsiemen, kuivattu | 5,3 | Parmesaani | 2,7 |
| Hedelmät ja marjat | Lehtisalaatti | 2,3–5,7 | Soijapapu, kuivattu | 21,9 | Raejuusto | 2,4 | |
| Ananas | 0,2 | Munakoiso | 2,2 | Voipapu, kuivattu | 10,0 | Voi, suolalla tai ilman | 0,4–0,7 |
| Appelsiini | 0,6–0,7 | Nauris | 1,9 | Liha ja kala | Muut | ||
| Avokado | 4,3 | Paprika | 2,7 | Kana, maksa | 227,4 | Hunaja | 2,2 |
| Banaani | 2,5 | Parsakaali | 6,5 | Kana, siipi tai jalka, iholla | 2,6–2,9 | Kahvi, suodatin, valmis juoma | 2,3 |
| Kiivi | 1,4 | Persilja | 6,0 | Makrilli | 6,9 | Kananmuna, keitetty | 15,9 |
| Kirsikka | 0,7 | Peruna | 1,8 | Nauta, filee | 1,4 | Kananmuna, keltuainen | 57,0 |
| Mango | 1,8 | Pinaatti | 4,0 | Nauta, maksa | 61,2 | Kananmuna, valkuainen | 7,4 |
| Mansikka | 2,2 | Porkkana | 2,6 | Nauta, munuainen | 56,4 | Kuivahiiva | 88,2 |
| Mustikka | 1,2 | Retiisi | 4,2 | Sardiini, öljyssä | 20,3 | Oliiviöljy | 0 |
| Omena | 1,6 | Selleri | 1,7 | Sika, kyljys tai kinkku | 1,5–1,7 | Punaviini | 1,4 |
| Päärynä | 0,3–0,9 | Tankoparsa | 3,6 | Sika, maksa | 54,5 | Rapsiöljy | 0 |
| Satsuma | 0,9 | Tomaatti | 1,7 | Tonnikala | 2,6 | Soijaöljy | 0 |
| Viinirypäle | 0,9 | Valkosipuli | 1,2 | Tyynenmerenturska | 1,7 | Valkoviini | 0,5 |
Kemia
muokkaa wikitekstiä
D-(+)-Biotiinilla on tasomainen typpeä sisältävä ureidorengas. Tässä on kiinni taipunut tetrahydrotiofeenirengas, jonka rikin viereisessä hiilessä on valeriaanahapporakenne.[7] Kaksoisrengasrakenne on taipunut venemäiseen konformaatioon.[23] Biotiinissa on 3 kiraliakeskusta eli sillä on 8 stereoisomeeriä (23), mutta vain (3aS,4S,6aR)-isomeeri toimii eliöissä vitamiinina. Se muodostaa valkeita tai värittömiä neulasmaisia kiteitä. Se on liukoinen veteen, erityisesti kuumiin tai heikosti emäksisiin vesiliuoksiin,[24] mutta liukenee hyvin myös etanoliin. Biotiini on vähäliukoinen dietyylieetteriin ja kloroformiin.[3] Kiinteä biotiini ei hajoa huoneenlämmössä, ilmassa tai juurikaan auringonvalossa. Se hajoaa voimakkaassa UV-säteilyssä, hapettimissa ja vahvoissa hapoissa tai emäksisissä.[24] Biotiinin tiheys on 1,41 g/cm3 ja sen kiteet ovat rombisia, joiden irtotiheys on 0,23–0,55 g/cm3.[2]
Analyysi
muokkaa wikitekstiäLuonnosta saatujen näytteiden biotiinipitoisuudet ovat pieniä, eikä biotiinissa ole voimakkaita kromoforeja, joten sen pitoisuuksia ei voida mitata suoraan spektrofotometrisesti.[25] Luonnollisia pitoisuuksia suurempia pitoisuuksia voidaan mitata 4'-hydroksiatsobentseeni-2-karboksyylihapolla (HABA, CAS-numero 1634-82-8), joka muodostaa vain biotiinia sitomattoman avidiinin kanssa ei-kovalenttisia komplekseja, joiden absorptiomaksimi on 500 nm – intensiteetti on siis likimain kääntäen verrannollinen suhteessa biotiinipitoisuuksiin.[8]
Luonnon pieniä pitoisuuksia taas mitataan esimerkiksi mikrobien avulla tarkkailemalla niiden kasvua. Joidenkin mikrobien kohdalla näytteen proteiinisitoutunut biotiini tulee hydrolysoida vapaaksi ennen kasvukoetta. Pitoisuuksia mitataan myös avidiinin, streptavidiinin tai muiden samanlaisten proteiinien avulla: näytteen tuntemattoman määrän biotiinia annetaan sitoutua avidiiniin tai sen jodannaiseen kilpailevasti isotooppileimatun biotiinin kanssa, jota on lisätty näytteeseen tunnettu määrä. Testi voi kuitenkin aliarvioida pitoisuuksia, sillä biotiinijohdannaisten sitoutuminen avidiiniin tai sen johdannaisiin on heikompaa kuin itse biotiinin.[8]
Johdannaiset
muokkaa wikitekstiäBiotiinilla on monia johdannaisia, joista keskeisimpiä on alla taulukossa.
 | |||||
|---|---|---|---|---|---|
| Nimi | X | n | z | Y | CAS-numero |
| Biotiini | S | 2 | 2 | COOH | |
| Biosytiini | S | 2 | 2 | CONH(CH2)4CH(NH2)COOH | 576-19-2 |
| Biotiinisulfoksidi | SO2 | 2 | 2 | COOH | 3376-83-8 |
| Biotiinisulfoni | SO | 2 | 2 | COOH | 40720-05-6 |
| Biotinoli | S | 2 | 2 | OH | 53906-36-8 |
| α-Dehydrobiotiini | S | 2 | 1 | COOH | 10118-85-1 |
| Detiobiotiini | 2 H | 2 | 2 | COOH | 15720-25-9 |
| Homobiotiini | S | 3 | 2 | COOH | 1784-22-1 |
| Norbiotiini | S | 1 | 2 | COOH | 669-72-7 |
| Oksibiotiini | O | 2 | 2 | COOH | 14474-91-0 |
| Selenobiotiini | Se | 2 | 2 | COOH | 57956-29-3 |
Valmistus
muokkaa wikitekstiäBiotiinia tuotetaan kaupallisesti kemiallisin synteesein, mutta ei käymisellä mikrobien avulla.[26] Synteesireittinä käytetään nykyään esimerkiksi ns. Goldberg-Sternbach-synteesimenetelmän muunnelmia. Reitissä voi olla noin 10 reaktiovaihetta ja yhtenä lähtöaineista käytetään usein fumaarihappoa.[27]
Toiminta eliöissä
muokkaa wikitekstiäBiotiini on tiettyjen karboksylaasi-entsyymien prosteettinen ryhmä (katso kohta Liitos karboksylaaseihin). Näissä vetykarbonaatti siirtyy biotiinin ureidorenkaan valeriaanahappohännästä kauimmaiseen typpeen väliaikaisesti sitoutuneena CO2:na karboksylaasin käsittelemään molekyyliin karboksyylihapporyhmäksi. Biotiini on kiinni valeriaanahapponsa karboksyylihaposta karboksylaasien tiettyihin lysiineihin amidisidoksella.[5] Nisäkkäillä biotiinikarboksylaaseja on 5,[17] ja niitä ovat
- pyruvaattikarboksylaasi.[8] Tämä tuottaa mitokondrioissa pyruvaatista oksaloasetaattia sitruunahappokierrossa.
- asetyylikoentsyymi-A-karboksylaasit 1 ja 2. Nämä ovat vastaavasti solulimassa ja mitokondrioissa osana rasvahapposynteesiä liittäen asetyyli-CoA:han vetykarbonaatin malonyyli-CoA:ksi.[8]
- propionyyli-CoA-karboksylaasi.[8] Tämä hapettaa mitokondrioissa lähinnä metioniinista, treoniinista ja haarautuneista aminohapoista (esim. isoleusiinista) saatua propionyyli-CoA:ta metyylimalonyyli-CoA:ksi, joka menee energian (ATP:n) tai glukoosin tuottoon (glukoneogeneesiin).[5]
- 3-metyylikrotonyyli-CoA-karboksylaasi (EC-numero 6.4.1.4).[8] Tämä on mitokondrioissa osana leusiinin hajotusta, joka voidaan tosin hajottaa valinnaisesti 3-hydroksi-isovaleriaanahappoa (CAS 625-08-1) muodostavalla reitillä.[5]
Edeltävien lisäksi mikrobeissa on tunnistettu muita karboksylaaseja.[8]
Muu biokemia
muokkaa wikitekstiäImeytyminen
muokkaa wikitekstiä
Ihmisillä ravinnon proteiineista biotiini irtoaa ohutsuolessa proteaasien katalysoimalla hydrolyysillä biosytiiniksi. Biotinidaasi (EC-numero 3.5.1.12) hajottaa tämän biotiiniksi ja lysiiniksi.[5] Vapaan biotiinin imeytyminen tapahtuu lähinnä ohutsuolen vatsalaukun puoleisessa päässä ja SMVT-kalvoproteiinin kautta (eng. sodium-dependent multivitamin transporter). Tämän geeni on SLC5A6. Myös pantoteenihappo imeytyy SMVT:n avulla. SMVT:t ovat symporttereita ja ottavat biotiinia (ja pantoteenihappoa) soluihin natriumionien siirtyessä samanaikaisesti myös soluun. Suolisoluista biotiini menee verenkiertoon.[28] Biotiini voi imeytyä myös passiivisesti ja hitaasti diffuusiolla ohut- ja paksusuolesta. Tämän imeytymistavan merkitys kasvaa biotiiniannosten ollessa suuria.[4]
SMVT:t osallistuvat biotiinin kuljetukseen myös muiden solutyyppien kalvojen läpi muualla kehossa kuten aivoissa, munuaisissa ja maksassa.[28]
Kuljetus
muokkaa wikitekstiäIhmisillä veriplasman biotiinista noin 12 % on sitoutunut kovalenttisesti proteiineihin, 7 % on sitoutunut proteiineihin väliaikaisesti (reversibeelisti, ei-kovalenttisesti) ja loput kulkeutuvat plasmaan liuenneena. Reversibeeli sitoutuminen on tiettyihin proteiineihin kohdentumatonta eli epäspesifistä ja se tapahtuu esimerkiksi α- ja β-globuleeneihin. Veressä on myös biotiinia spesifisesti sitovia biotinidaaseja.[5]
Varastoituminen
muokkaa wikitekstiäEläimillä biotiini varastoituu pääosin maksaan, jonka pitoisuudet ovat eliöstä riippuen usein 0,8–3 µg/g. Lisäksi on tunnistettu biotiinia spesifisesti ja väliaikaisesti sitovia proteiineja lintujen ja matelijoiden munista – nämä proteiinit ovat erilaisia kuin avidiini tai vastaavat proteiinit.[5] Ihmiskehon biotiini riittää noin kuukaudeksi[29] ja selkeitä puutosoireita ilmenee terveillä noin 5 viikon kuluttua biotiinin saannin loppumisesta.[30]
Hajotus ja erittyminen
muokkaa wikitekstiäNisäkkäillä vain pieni osa biotiinista hapettuu biotiinin D- tai L-sulfoksideiksi. Ureidorengas ei muunnu, mutta 5-hiilinen häntärakenne voi hapettua mitokondrioiden β-oksidaatiossa, jolloin jäljelle jää 3-hiilisen hännän omaava bisnorbiotiini. Ihmisillä biotiiniylimäärä erittyy pian ulos kehosta lähinnä virtsassa. Tästä noin puolet on biotiinia. Loput ovat moninainen seos esimerkiksi bisnorbiotiinia, bisnorbiotiinin metyyliketonia, biotiinisulfonia ja tetranorbiotiini-L-sulfoksidia. Biotiinia on eliöillä myös ulosteessa, mutta tämä on pääosin suolimikrobien tuottamaa.[5]
Liitos karboksylaaseihin
muokkaa wikitekstiäBiotiini liittyy eläimissä ja monissa mikrobeissa amidisidoksilla inaktiivisten karboksylaasien eli ns. apokarboksylaasien tiettyjen lysiinien aminoryhmiin. Tätä entsyymejä aktivoivaa kondensaatioreaktiota katalysoi holokarboksylaasisyntaasi (EC 6.3.4.10):[17][31]
Kierrätys
muokkaa wikitekstiäEläimissä biotiinia sitovat entsyymit hajoavat proteolyyttisesti biosytiiniksi, joka sitoo valeriaanahapponsa karboksyylihaposta lysiinin amidisidoksella. Biosytiini hydrolysoituu biotinidaasilla (EC 3.5.1.12) biotiiniksi, joka voidaan taas käyttää muissa karboksylaaseissa. Biotinidaasin reaktio on:[5][32]
- biosytiini + H2O ⇌ biotiini + lysiini
Avidiini ja sen johdannaiset
muokkaa wikitekstiäMuun muassa raaoissa kananmunissa oleva avidiini-glykoproteiini muodostaa vahvan sidoksen biotiinin ureidorenkaaseen.[17] Sidoksia muodostuu suhteessa 4:1 (biotiini:avidiini) mooleina. Tämä on vahvimpia tunnettuja ei-kovalenttisia sidoksia. Sidos ei katkea entsymaattisesti tai hapoilla, vaan denaturoimalla avidiini säteilyttämällä tai kuumentamalla sitä yli lämpötilan 100 °C. Vastaavia sidoksia muodostuu myös streptavidiinin (CAS-numero 9013-20-1) ja stravidiinin (CAS 97276-57-8) välille.[24]
Historia ja nimet
muokkaa wikitekstiä
Eugene Wildiers (1878–1908) esitti työskennellessään Antwerpenissä vuonna 1901 olevan tuntematon orgaaninen aine, jota hiivat vaativat normaaliin kasvuun muiden perusaineiden, kuten suolojen, sokerin ja sopivan typpilähteen lisäksi. Tuntematonta ainetta hän kutsui nimellä bios, joka on kreikkaa: βίος eli elämä.[1]
Margaret Averil Boas havaitsi Lontoon Lister-instituutissa vuonna 1927 raakojen kananmunan valkuaisten syöttämisen rotille aiheuttavan niillä poikkeavia oireita, kuten karvanlähtöä, ihottumaa, kyyristyneen ryhdin, nopean painon alenemisen ja kuoleman viikoissa. Hän havaitsi muun muassa leivinhiivauutteen tai kalanmaksaöljyn estävän oireita. Boas päätteli näissä ravinnelähteissä olevan tuntematon oireita estävä aine. Hän totesi sen vesiliukoiseksi ja esitti sen olevan tuolloin tunnettujen B-vitamiinien kaltainen.[33][1] Yhdysvaltain maatalousministeriölle (USDA) työskennelleet Franklin Allison, Sam Hoover ja Dean Burk esittivät vuonna 1933 olevan olemassa tuntematon vesiliukoinen "koentsyymi R". R tulee englannin sanasta respiration eli hengittäminen, sillä he totesivat aineen olevan tärkeä osa soluhengitystä.[34][1]
Fritz Kögl (1897–1959) ja Benno Tönnis eristivät biotiinikiteitä 250 kilogrammasta keitettyjä ankanmunia Utrechtin yliopistossa vuonna 1936. He nimesivät aineen biotiiniksi, arvellen sen olevan osa E. Wildiersin ehdottamaa bios-tekijää.[35][1] Paul György ja kollegat pyrkivät vuonna 1939 eristämään aineen, joka esti rotilla munanvalkuaisten syötön aiheuttamia oireita. He kutsuivat ainetta H-vitamiiniksi.[36][37] H tulee saksan sanasta haut eli iho, sillä aine esti valkuaisruokinnan aiheuttamia iho-oireita.[1] Viimeistään 1940 mennessä koentsyymin R, H-vitamiinin ja biotiinin tiedettiin olevan sama aine niiden samanlaisten ominaisuuksien vuoksi.[38]

Paul György ja kollegat esittivät vuonna 1941 valkuaisissa biotiinipuutosta aiheuttavan aineen olevan albumiinin kaltainen. He nimesivät sen avidalbumiiniksi, jossa avid tulee latinan sanasta nälkäisyys. Sanayhdistelmä tarkoittaa nälkäistä albumiinia johtuen sen kohdentuneesta sitoutumisesta biotiiniin eli biotiinin "nälästä".[39][1] Nimi typistettiin vielä samana vuonna avidiiniksi. Tämä on englanniksi avidin ollen avid ja biotin sanayhdistelmä.[40][41]
Vincent du Vigneaud ja kollegat selvittivät Cornell-yliopistossa biotiinin empiirisen kaavan vuonna 1941[42][43] ja rakennekaavan seuraavana vuonna sen hajoamistuotteiden perusteella.[44][1] Karl August Folkers (1906–1997) ja kollegat syntetisoivat biotiinin rasemaatin vuotta myöhemmin Merckin laboratorioissa New Jerseyn Rahwayssa.[45][1]
Max Planck -instituutissa toimineet Feodor Lynen ja kollegat saivat selville vuonna 1959, että biotiini toimii karboksylaasi-entsyymeissä prosteettisena ryhmänä. He totesivat tämän biotiinin toiminnon ensi kerran 3-metyylikrotonyyli-CoA-karboksylaasissa.[46][1] James Trotter ja Jean A. Hamilton julkaisivat biotiinin vitamiinina toimivan isomeerin stereoisomerian vuonna 1966.[47][43]
Lähteet
muokkaa wikitekstiä- GF Combs et al: The vitamins: fundamental aspects in nutrition and health. 3. painos. Elsevier Academic Press, 2008. ISBN 9780121834937.
- J Zempleni et al: Handbook of vitamins. 4. painos. Taylor & Francis, 2007. ISBN 9780849340222.
Viitteet
muokkaa wikitekstiäAiheesta muualla
muokkaa wikitekstiä- Linus Pauling Institute: Biotin (englanniksi)
- HMDB: Biotin (englanniksi)
- Food Component Database (FooDB): Biotin (englanniksi)
- KEGG: Biotin (englanniksi)
- The Small Molecule Pathway Database (SMPDB): Biotin Metabolism, Homo sapiens (englanniksi)
- Liber Herbarum II: Biotiinia sisältäviä kasveja (englanniksi)
- Dr. Duke's Phytochemical and Ethnobotanical Databases: Biotin (englanniksi)
| ||||||||||||||||||||||||||||||