پلیآدنیله شدن
پلیآدنیله شدن (به انگلیسی: Polyadenylation)، افزودن دُم پُلی(A) به آرانای پیامرسان (mRNA) است. دم پلی(A) شامل چندین آدنوزین مونوفسفات است؛ به بیان دیگر، یک توالی از آرانای است که تنها شامل بازهای آدنین میباشد. در یوکاریوتها، پلیآدنیله شدن، بخشی از فرایند تولید آرانای پیامرسان بالغ جهت ترجمه است. در بسیاری از باکتریها، دم پلی(A)، تجزیهٔ آرانای پیامرسان را ترغیب میکند؛ بنابراین بخشی از فرایند بیان ژن را تشکیل میدهد.

فرایند پلیآدنیله شدن، پس از پایان رونویسی یک ژن آغاز میگردد. قطعهای از پیش-mRNA تازه ساخته شده که در سمت '۳ قرار دارد، ابتدا توسط مجموعهای از پروتئینها جدا شده؛ سپس این پروتئینها دم پلی(A) را در انتهای '۳ سنتز میکنند. در برخی از ژنها، این پروتئینها دم پلی(A) جدیدی را در یکی از چندین مکان ممکن میافزایند؛ بنابراین، پلیآدنیله شدن، توانایی تولید بیش از یک رونوشت را از یک ژن واحد داراست (پلیآدنیله شدن جایگزین)، که مشابه پیرایش جایگزین است.[۱]
دم پلی(A) در خروج از هسته، ترجمه و پایداری آرانای پیامرسان اهمیت دارد. دم طی زمان کوتاه شده، و هنگامی که به میزان کافی کوتاه شود، آرانای پیامرسان با استفاده از آنزیمها تجزیه میگردد.[۲] با این حال، در برخی از انواع سلولها، آرانایهای پیامرسانی با دمهای کوتاه پلی(A) برای فعالسازیهای بعدی به کمک باز-پلیآدنیله شدن در سیتوزول، ذخیره میگردند.[۳] در مقایسه، هنگامی که در باکتریها پلیآدنیله شدگی رخ دهد، تجزیهٔ آرانای را ترغیب میکند.[۴] چنین اتفاقی برخی مواقع در آرانایهای غیر-کدکننده یوکاریوتی نیز رخ میدهد.[۵][۶]
مولکولهای آرانای پیامرسان در هردو دستهٔ پروکاریوتها و یوکاریوتها، دارای انتهای '۳ پلیآدنیلهاند، به گونهای که دمهای پلی(A) پروکاریوتی عمدتاً کوتاهتر بوده و مولکولهای آرانای پیامرسان پلیآدنیلهشدهٔ کمتری دارند.[۷]
مروری بر آرانای
آرانایها نوعی از مولکولهای زیستی بزرگی هستند که از بلوکهای منحصر به فردی بهنام نوکلئوتید (آدنین، سیتوزین، گوانین و یوراسیل) ساخته شدهاند. آرانای از روی الگوی دیانای ساخته میشود. طبق قرارداد، دنبالهٔ آرانای از انتهای ۵'به سمت انتهای ۳' نوشته میشود؛ بنابراین، انتهای ۵' زودتر از انتهای ۳' رونویسی میشود. همچنین، انتهای ۳' محلی است که دنبالهٔ آدنین برای چندآدنینهشدن قرار میگیرد.[۸]
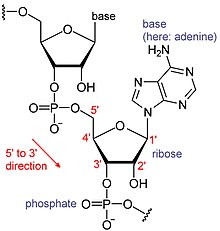
آرانای پیامرسان، نوعی آرانای دارای نواحی رمزشدهای است که برای تولید پروتئین (ترجمه)استفاده میشوند. دیگر قسمتهای آرانای پیامرسان، نواحی ترجمهنشدهای هستند که میزان فعال بودن آرانای پیامرسان را تنظیم میکنند.[۹] تعداد زیادی آرانای وجود دارد که ترجمه نشدهاند و آرانای بیرمز نام دارند. مشابه نواحی ترجمهنشده، بیشتر آرانایهای بیرمز، نقش تنظیمکننده دارند.[۱۰]
چندآدنینهشدن هستهای
وظیفه
در پلیآدنیلهشدن هستهای، دنبالهٔ آدنین به آرانای در انتهای رونویسی اضافه میشود. در آرانای پیامرسان، دنبالهٔ آدنین مولکول در آرانای پیامرسان را از تجزیهٔ آنزیمی در سیتوپلاسم سلول محافظت میکند و در پایان رونویسی، به خروج آرانای پیامرسان از هسته و ترجمهٔ آن کمک میکند. تقریباً تمام آرانایهای پیامرسان یوکاریوتی چندآدنینه میشوند.[۱۱] به استثنای هیستون آرانایهای پیامرسان وابسته به تکثیر حیوانات.[۱۲] این آرانایهای پیامرسان تنها آرانایهای پیامرسانی در یوکاریوتها هستند که دنبالهٔ آدنین ندارند و به جای آن در یک ساختار ساقه-حلقه به دنبال یک توالی غنی از پورین که هیستون عنصر پاییندست نامیده میشوند و مشخص میکنند چه زمانی آرانای قطع شدهاست و در نتیجه انتهای ۳' هیستون آرانای پیامرسان شکل گرفتهاست، پایان مییابند.[۱۳]بیشتر آرانایهای بیرمز یوکاریوتی در انتهای رونویسی چندآدنینه میشوند. آرانایهای کوچکی وجود دارند، مانند ریزآرانای، که دنبالهٔ آدنین فقط در شکلهای میانی آنها دیده میشوند نه در شکل کامل آن.[۱۴][۱۵] اما برای بیشتر آرانایهای بیرمز طولانی، دنبالهٔ آدنین بخشی از آرانای کامل است.[۱۶]
مکانیزم
سیستم پلیآدنیلهسازی در هستهٔ یوکاریوتها، روی محصولات آرانای پلیمراز II کار میکند، مانند آرانایهای پیامرسان پیشرو. در این، جا یک مجموعه شامل چند پروتئین، بخش ۳' از آرانای جدید تولیدشده را میشکافند و انتهای ناحیهٔ شکافتهشده را پلیآدنیله میکنند. این شکاف کاتالیزشده توسط آنزیم CPSF و در ۱۰–۳۰ نوکلئوتید پایینتر از محل اتصال، رخ میدهد.[۱۷] در این ناحیه روی آرانای اغلب دنبالهٔ AAUAAA وجود دارد، اما انواع مختلف آن که بهصورت ضعیف به CPSF وصل شدهاند نیز وجود دارد.[۱۸] دو پروتئین دیگر نیز بهطور اختصاصی به آرانای وصل میشوند: CstF و CFI.[۱۹]CstF ککک به ناحیهٔ غنی از GU و پایینتر از ناحیهٔ CPSF وصل میشود. CFI ناحیهٔ سوم آرانای (مجموعهای از UGUAAها در پستانداران[۲۰][۲۱][۲۲]) را به رسمیت میشناسد و حتی اگر دنبالهٔ AAUAAA وجود نداشته باشد بازهم میتواند CPSF را بهکار گیرد.[۲۳][۲۴] سیگنال پلیآدنیلهشدن –دنبالهای از الگوهای شناخته شده توسط مجموعه شکاف دهنده آرانای- بین گروههای یوکاریوتی متفاوت است. بیشتر ناحیههای پلیآدنیله شدن انسانها شامل AAUAAA است اما این دنباله در بین گیاهان و قارچها کمتر رایج است.[۲۵]آرانای معمولاً قبل از پایان رونویسی شکافته میشود و CstF به آرانای پلیمرازΙΙمتصل میشود.[۲۶] پروتئین CFI همچنین در عملیات شکافتن نقش دارد (اگر چگونگی آن هنوز ناشناخته است).[۲۷] ناحیهٔ شکاف میتواند تا حدود ۵۰ نوکلئوتید متفاوت باشد.[۲۸]وقتی آرانای شکافته شد، فرایند چندآدنینی شروع شده و توسط پلیمراز چندآدنینی کاتالیز میشود. پلیمراز چندآدنینی، دنبالهٔ آدنین را با اضافه کردن ادنوزین منو فسفات از ادنوزین تری فسفات (با شکافتن پیروفسفات) میسازد. پروتئین دیگر، PAB2،[۲۹] به دنبالهٔ آدنین کوتاه جدید متصل میشود و میل پلیمراز چندآدنینی برای اضافه کردن طول دنبالهٔ آدنین به آرانای را افزایش میدهد.[۳۰][۳۱] وقتی طول دنبالهٔ آدنین به حدود ۲۵۰ نوکلئوتید رسید، آنزیم دیگر نمیتواند CPSF را متصل نگه دارد و فرایند پلیآدنیلهشدن متوقف میشود و به این ترتیب طول دنبالهٔ آدنین مشخص میشود. CPSF با آرانای پلیمرازΙΙ در ارتباط است و اجازه ارسال سیگنال پایان رونویسی به پلیمراز را میدهد.[۳۲][۳۳] مکانیزم چندآدنینیشدن همچنین بهطور فیزیکی با پیرایش که مجموعهای که اینترونها را از آرانای حذف میکنند، ارتباط دارد.
اثرهای پاییندست
دنبالهٔ آدنین بهعنوان ناحیهٔ ضروری برای پروتئینهای ضروری آن عمل میکند. این پروتئینها اجازه خروج آرانای پیامرسان از هسته سلول و ترجمه آن را میدهند و از تجزیه آن جلوگیری میکنند.[۳۴] این پروتئینها قبل از خروج آرانای پیامرسان از هسته به آن متصل میشوند و در مخمرها، همچنین هستهٔ دنباله به کار گرفته میشود تا با استفاده از آن دنبالهٔ آدنین کوتاه شده و اجازه خروج آرانای پیامرسان داده شود. این پروتئینها همراه با آرانای به سیتوپلاسم صادر میشوند و آرانای پیامرسانی که صادر نشده باشد توسط اگزوزوم تجزیه میشود.[۳۵][۳۶] همچنین، این پروتئینها میتوانند به پروتئینهای دیگری که روی ترجمه اثر میگذارند متصل شوند و از آنها استفاده کنند. یکی از این پروتئینها فاکتور شروع-4G است که به نوبه خود باعث شروع به کار واحد کوچک ریبوزوم(40S) میشود.[۳۷] با اینحال، دنبالهٔ آدنین برای ترجمهٔ همهٔ آرانای پیامرسانها ضروری نیست.[۳۸]
حذف گروهی از پروتئینها(deadenylation)
در سلولهای سوماتیک یوکاریوتی، طول دنبالهٔ آدنینی در سیتوپلاسم به تدریج کوتاهتر میشود، و آرانایهای پیامرسانی با دنبالهٔ کوتاه آدنینی کمتر ترجمه شده و در نتیجه زودتر تجزیه میشوند.[۳۹] با این حال، این تجزیه چندین ساعت طول خواهد کشید.[۴۰] این فرایند حذف و تجزیه میتواند توسط میکروآرانایهای مکمل ناحیهٔ ترجمه نشده ۳’ تسریع شود.[۴۱] در سلولهای تخم نابالغ، آرانایهای پیامرسانی که طول دنباله آدننین کوتاه دارند تجزیه نمیشوند، بلکه بدون ترجمه شدن ذخیره میشوند. سپس در دوران فعالیت تخم و بعد از لقاح توسط پلیآدنیلهشدن سیتوپلاسمی فعال میشوند.[۴۲]در حیوانات، پلی آدنین ریبونوکلئاز (PARN) میتواند به کلاه ۵’ متصل شده و نوکلئوتیدهای دنبالهٔ آدنین را حذف کند. سطح دسترسی به کلاه ۵’ و دنبالهٔ آدنین در کنترل اینکه چه مدت دیگر آرانای پیامرسانی باید تجزیه شود تأثیر دارد. PARN پروتئین کمتری را حذف میکند اگر آرانای توسط فاکتورهای شروع 4E در کلاه ۵’ و 4Gدر دنباله آدنین محدود شده باشد که در نتیجه عمل ترجمه باعث کاهش حذف پروتئین میشود. نرخ حذف شدن ممکن است توسط پروتئینهای ضروری آرانای تنظیم شود. وقتی که دنبالهٔ آدنین حذف شد، مجموعه پروتئینهای حذفکنندهٔ کلاه، کلاه ۵’ را حذف میکنند و در نتیجه آرانای تجزیه میشود. چندین آنزیم دیگر که در حذف پروتئینها از مخمها نقش دارند نیز شناخته شدهاند.[۴۳]
چندآدنینهشدن جایگزین
بیشتر ژنهای کدکننده پروتئین بیشتر از یک محل برای چندآدنینه شدن دارند و در نتیجه برای یک ژن چندین نسخه متفاوت آرانایهای پیامرسانی که در انتهای ۳’شان متفاوتند وجود دارد.[۴۴][۴۵] چون چندآدنینه شدن جایگزین طول ناحیه ترجمه نشده ۳’ را تغییر میدهد، میتواند باعث تغییر مکانهایی که برای اتصال میکرو آرانای در ناحیههای ترجمه نشده ۳’ است، شوند.[۴۶] میکرو آرانای تمایل به سرکوب ترجمه و تجزیه آرانایهای پیامرسانی که به آنها متصلاند را دارند، اگر چه مثالهایی از میکرو RNAهایی که رونوشت پایداری دارند نیز وجود دارد.[۴۷][۴۸] چندآدنینه شدن جایگزین میتواند باعث کوتاه شدن ناحیه رمز نگاری شده شود که باعث میشود ایجاد کد آرانای پیامرسان برای یک پروتئین متفاوت شود.[۴۹][۵۰] اما این اتفاق نسبت به اینکه فقط ناحیه ترجمه نشده ۳’ کوتاه شود، کمتر رایج است.

انتخاب ناحیه پلیآدنین میتواند توسط محرکهای خارج سلولی و وابسته به بیان پروتئینهایی که در چندآدنینه شدن نقش دارند، تأثیر پذیرد.[۵۱][۵۲] برای مثال، بیان CstF-64، یک زیرواحد از فاکتور تحریککننده شکاف (CstF)، در ماکروفاژهای پاسخ به لیپوپلیساکارید (یک گروه از ترکیبات باکتریایی که باعث یک پاسخ ایمنی میشوند) افزایش مییابد. این اتفاق نتیجهٔ انتخاب محلهای پلی ادنین ضعیف است و در نتیجه رونوشت کوتاهتر میشود. این عناصر تنظیمکننده در ناحیه ترجمه نشده۳’ از آرانای پیامرسان برای محصولات مرتبط با دفاع مثل لیزوزم و عامل نکروز توموری آلفا را حذف میکند. این آرانایهای پیامرسان نیمه-عمر طولانیتری دارند و تعداد بیشتری از این پروتئینها را تولید میکنند. پروتئینهای ضروری آرانای نسبت به دیگر پروتئینهایی که در مکانیزم چندآدنینه شدن نقش دارند میتوانند این که آیا یک سایت برای چندآدنینه شدن استفاده شود یا نه[۵۲][۵۳][۵۴][۵۵] و همچنین دیانای متیلاسیون نزدیک نواحی چندآدنینه شدن را تحت تأثیر قرار دهند.[۵۶]
چندآدنینه شدن سیتوپلاسمی
چندآدنینه شدن در سیتوزول برخی از انواع سلولهای حیوانی وجود دارد، یعنی در راستای نطفه، در رویانزایی و در محلهای پسا-سیناپسی در یاخته عصبی. این پلیآدنیله شدن سیتوزولی سبب افزایش طول دنباله آدنین در آرانایهای پیامرسان با دنباله ادنین کوتاه میشود بنابراین این آرانایهای پیامرسان ترجمه خواهند شد.[۵۷] طولهای کوتاه حدوداً ۲۰ نوکلئوتید دارند و به حدود ۸۰–۱۵۰ نوکلئوتید افزایش پیدا خواهند کرد.در جنین ابتدایی موش، چندآدنینه شدن سیتوزولی در آرانایهای مادر سلول تخم، اجازه میدهند سلول زنده مانده و رشد کند حتی اگر رونویسی تا میانههای سطح ۲-سلول (سطح ۴سلول در انسان) آغاز نشده باشد.[۵۸][۵۹] درمغز، چندآدنینه شدن سیتوزولی در طول یادگیری فعال شده و میتواند نقش مهمی را در تقویت انتقال سیگنال از یک سلول عصبی به سلول دیگر و برای یادگیری و شکلگیری حافظه داشته باشد.[۶۰]چندآدنینه شدن سیتوپلاسمی به پروتئینهای CPSF و CPEB ویا حتی پروتئینهای دیگری مثل پومیلیو نیاز دارد.[۶۱] بسته به نوع سلول، پلیمراز میتواند همنوع پلیمراز چندآدنینی (PAP)که در فرایند هسته استفاده میشود یا پلیمراز سیتوپلاسمی GLD-2 باشد.[۶۲]
برچسب تجزیه در یوکاریوتها
برای بسیاری از آرانایهای بی رمز، مثل آرانای حامل، و آرانای ریبوزومی و آرانای کوچک هستهای، پلیآدنیله شدن یک راه برای علامتگذاری برای تجزیه شدن آرانای است، حداقل در مخمرها.[۶۳] این پلیآدنیله شدن در هسته و توسط ترکیب TRAMP انجام میشود، به این ترتیب که یک دنباله با طول حدود ۴۰ نوکلئوتید را به انتهای ۳’ اضافه میکند.[۶۴] سپس آرانای توسط اگزوزوم تجزیه میشود.[۶۵] دنبالهٔ آدنین همچنین در بخشهایی از آرانای ریبوزومی انسان در هر دو شکل هموپلیمر (فقط شامل آدنین) و هتروپلیمر (بیشتر شامل آدنین) یافته شدهاست.[۶۶]
در یوکاریوتها و اندامکها
در بسیاری از باکتریها هم آرانایهای پیامرسان و هم آرانایهای بی رمز میتوانند چندآدنینه شوند. این دنبالهٔ آدنین، تجزیه توسط دیگرادوزوم که شامل دو آنزیم تجزیهکنندهٔ آرانای است (پلیمراز چندآدنینه و RNase E)را جلو میاندازد. پلیمراز چندآدنینه به انتهای ۳’ آرانای متصل شده و به این ترتیب پسوند۳’ تولید شده توسط دنبالهٔ آدنین اجازه پیدا میکند که به آرانای متصل شود و ساختار دوم برای آن ایجاد شده و انتهای ۳’ مسدود شود. دورهای بعدی چندآدنینه شدن و تجزیه انتهای ۳’ توسط پلیمراز چندآدنینه اجازه میدهند که دگرادوزوم بر این ساختارهای دوم غلبه کند. دنبالهٔ آدنین همچنین میتواند با بهکارگیری RNases آرانای را به دو قسمت تقسیم کند.[۶۷] این دنبالههای آدنینی باکتریایی حدود ۳۰ نوکلئوتید طول دارند.[۶۸]

در حیوانات و متهتنسانان، میتوکندری شامل هر دو حالت دنبالهٔ آدنین پایدار و ناپایدار است. چندآدنینه شدن ناپایدار آرانایهای پیامرسان و آرانایهای بی رمز را هدف قرار میدهد. دنبالهٔ آدنین بهطور متوسط ۴۳ نوکلئوتید طول دارد که در حالت پایدار از رمز پایان شروع میشوند و بدون آنها رمز پایان (UAA) مانند ژنومی که فقط ناحیه U یا UA را کد میکند، کامل نیست. میتوکندری گیاهان فقط چند آدنینیه ناپایدار دارند و میتوکندری مخمرها بهطور کلی چندآدنینه شدن ندارد.[۶۹]بیشتر باکتریها و میتوکندری علاوه بر پلیمراز چند، نوع دیگری از چندآدنینه شدن که توسط خود فسفریلاز پلی نکلئوتید اجرا میشود، را نیز دارند. این آنزیم در باکتری،[۷۰] میتوکندری[۷۱] و دیسه[۷۲] یافت شده و همچنین در اگزوزوم ارکیا هم وجود دارد (در آرکیهایی که اگزوزوم دارند).[۷۳] این آنزیم میتواند پسوند ۳’ در محلی که بیشتر آدنین وجود دارد را سنتز کند. مانند باکتری و آرکیها، پلیآدنیله شدن توسط فسفوریلاز پلی نوکلئوتید تجزیه آرانای را در دیسه[۷۴]ها جلو میاندازد.
سیر تکاملی
اگرچه چندآدنینه شدن در تقریباً تمام موجودات دیده میشود، اما حقیقتی فراگیر نیست.[۷۵][۷۶] با این حال، توزیع گسترده از این تغییر و این که در حال حاضر در تمام سه دامنه موجودات زنده وجود دارد نشان دهنده این است که در جد مشترک فرض شده برای تمامی این موجودات نیز سیستم چندآدنینه شدن وجود داشتهاست. و اینکه در تعداد کمی از موجودات چندآدنینه شدن آرانای پیامرسان ندارند، نشان دهنده این است که در روند تکاملی این موجودات، این سیستم از بین رفتهاست. اگرچه هیچ مثالی از موجودات یوکاریوتی که چندآدنینه شدن نداشته باشند وجود ندارد، اما آرانایهای پیامرسان باکتری مایکوپلاسما گالی سپتیکوم و آرکیهای بدون قابلیت تحمل نمک هالوفراکس ولکانی این نقص را دارند.[۷۷][۷۸]قدیمیترین آنزیم چندآدنینی، فسفوریلاز پلی نکلئوتید است.[۷۹] این آنزیم بخشی از هر عامل تجزیه باکتری و اگزوزوم ارکیا است، دو ترکیب نسبتاً نزدیک که آرانای را به نوکلئوتیدهای سازنده اش بازیافت میکند. این آنزیم ا آرانای را با حمله به پیوند بین نکلئوتیدهای انتهای ۳’ با فسفاتها و شکستن نکلئوتید فسفات، تجزیه میکند. این عملی بازگشتپذیر است و بنابراین این آنزیم میتواند با اضافه کردن نوکلئوتیدها، آرانای را گسترش دهد.[۸۰]
تاریخچه
چندآدنینه شدن برای اولین بار در دهه ۱۹۶۰ به عنوان یک فعالیت آنزیمی در هسته سلول شناخته شد که میتوانست ATP را به پلیآدنین تبدیل کند.[۸۱][۸۲] اگرچه در بسیاری از سلولها وجود این آنزیم مشخص شد اما تا سال ۱۹۷۱ که دنباله پلی آدنین در آرانایهای پیامرسان شناخته شد، هیچ وظیفهای برای این فعالیت تشخیص داده نشد.[۸۳][۸۴] در ابتدا تصور میشد تنها وظیفهٔ این دنبالهها محافظت انتهای ۳’ آرانای از نوکلئوتید هاست اما بعداً نقش چندآدنینه شدن در خروج آرانای پیامرسان از هسته و ترجمهٔ آن شناخته شد. پلیمراز چندآدنینه شدن اولین بار در دههٔ ۱۹۶۰ و ۱۹۷۰ شناسایی شد اما پروتئینهای جانبی آن که این فرایند را کنترل میکنند در ابتدای دههٔ ۱۹۹۰ کشف شد.
منابع
- مشارکتکنندگان ویکیپدیا. «Polyadenylation». در دانشنامهٔ ویکیپدیای انگلیسی.