Fosfano
El fosfano[2] (PH3) es un gas incoloro, inflamable, que explota a temperatura ambiente y que huele a ajo. Pequeñas cantidades se producen naturalmente provenientes de la degradación de materia orgánica. Es levemente soluble en agua y es extremadamente venenoso.
| Fosfano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Fosfano | ||
| General | ||
| Otros nombres | Fosfina Fosfamina Hidruro de fósforo Trihidruro de fósforo | |
| Fórmula estructural |  | |
| Fórmula molecular | PH3 | |
| Identificadores | ||
| Número CAS | 7803-51-2[1] | |
| Número RTECS | SY7525000 | |
| ChEBI | 30278 | |
| ChEMBL | CHEMBL2227836 | |
| ChemSpider | 22814 | |
| PubChem | 24404 | |
| UNII | FW6947296I | |
| Propiedades físicas | ||
| Apariencia | Gas incoloro | |
| Densidad | 1,379 kg/m³; 0,001 g/cm³ | |
| Masa molar | 3 399 746 g/mol | |
| Punto de fusión | 139 K (−134 °C) | |
| Punto de ebullición | 185 K (−88 °C) | |
| Propiedades químicas | ||
| Solubilidad en agua | 31.2 mg/100 ml | |
| Momento dipolar | 0.58 D | |
| Peligrosidad | ||
| NFPA 704 |
4 4 2 | |
| Temperatura de autoignición | 311 K (38 °C) | |
| Frases R | R12, R17, R26, R34, R50 | |
| Frases S | (S1/2), S28, S36/37, S45, S61, S63 | |
| Compuestos relacionados | ||
| Otros | Amoníaco Arsina Estibina Bismutina | |
| Compuestos orgánicos | Trimetilfosfano Trifenilfosfano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El fosfano es usado en las industrias de semiconductores y de plásticos, en la producción de un retardador de llamas y como insecticida en granos almacenados.
Propiedades físicas y químicas
El fosfano se ha llamado también fosfina, fosfuro de hidrógeno o hidrógeno fosforado, aunque el nombre recomendado en la actualidad por la Unión Internacional de Química Pura y Aplicada (IUPAC) es fosfano.[2] Es una molécula polar. Es un gas incoloro, poco soluble en el agua, que se reconoce por su olor aliáceo y su gran combustibilidad. Al aire arde con llama de color blanco y muy brillante, desprendiendo vapores de ácido fosfórico, según la reacción: PH3 + 2O2 → H3PO4Es un poderoso reductor que se apropia del oxígeno de muchos cuerpos para transformarse en ácido fosfórico. Por esta propiedad es extremadamente venenoso, pues deja al cuerpo humano sin oxígeno necesario.Se une con los hidrácidos para formar compuestos que son isomorfos con las sales amónicas, por ejemplo: PH3 + HCl → PH4Cl. El radical PH4+ monovalente se llama fosfonio y es parecido al amonio (NH4+).
Características
- Fórmula: PH3
- Masa molecular: 34 Da;
- Solubilidad a 15 °C: 112 cm³;
- Valencia del fósforo: -3;
- Estado físico (a 20 °C): gas incoloro;
- Densidad (25 °C): 1.37
Reacciones principales
Existen dos métodos de obtención bastante empleados en los laboratorios:
Ca3P2 + 6H2O → 2PH3 + 3Ca(OH)2
P4 + 3NaOH + 3H2O → PH3 + 3NaH2PO2
Debido a su volatilidad, siempre se realizan este tipo de reacciones en vitrina extractora, y normalmente habiendo montado un sistema que impida la salida del gas a la atmósfera, ya que es tremendamente inflamable, según la reacción
PH3 +2O2 → H3PO4
Uso como insecticida
Se vende en forma de pastillas que contienen fosfuro de aluminio (AIP) cubiertas de parafina y mezcladascon carbonato amónico. Cuando el producto se saca del envase en el que se vende y entra en contacto con la humedad del ambiente, se desprende fósforo de hidrógeno (fosfano) gaseoso extremadamente tóxico, el cual es la sustancia activa que mata a los insectos, tanto en fase de huevo como de larva, pupa e insecto adulto. El gas penetra en el cuerpo de los insectos durante el proceso de respiración, a través de los estigmas. En caso de ingesta por humanos, bien accidental o con fines suicidas, el polvo al llegar al estómago, desprende el gas tóxico, que puede ser peligroso no solo para el sujeto que lo ingiere, sino para personas próximas o el personal sanitario que atiende al paciente y respiran aire contaminado con el aliento de la persona intoxicada.[3]
Toxicidad
La ruta más probable de exposición al fosfano es la inhalación. Los primeros síntomas de exposición aguda al fosfano incluyen dolor del diafragma, náusea, vómitos, excitación y un olor a fósforo en el aliento. La exposición a niveles más altos puede producir debilidad, bronquitis, edema pulmonar, falta de aliento, convulsiones y la muerte. Algunos efectos, como por ejemplo edema pulmonar, convulsiones y daño del hígado pueden manifestarse o aun estar presentes días después de la exposición.
La exposición prolongada a bajos niveles de fosfano puede producir anemia, bronquitis, efectos gastrointestinales, y problemas motores, de la vista y del habla.
El contacto del fosfano líquido con la piel puede producir congelación. La ingestión de fosfuro metálico puede producir la liberación de fosfano en el estómago lo que puede causar náusea, vómitos, dolor abdominal y diarrea.
No hay ninguna información disponible acerca de los posibles efectos de la fosfamina sobre la reproducción en seres humanos. No se ha demostrado que el fosfano afecte la reproducción en animales de laboratorio.
Fosfanos orgánicos
Relacionada con el PH3 es la clase de los compuestos de organofósforo comúnmente denominados "fosfanos". Estos derivados de alquilo y arilo del fosfano son análogos a las aminas orgánicas. Algunos ejemplos comunes incluyen el trifenilfosfano ((C6H5)3P) y BINAP, ambos usados como ligandos en catálisis homogénea, o el triisopropilfosfano. Los fosfanos son oxidados fácilmente a óxidos de fosfano, como está ejemplificado por la síntesis directa de una fosfa-corona, el análogo de fósforo de una aza corona[4] donde no es posible aislar el fosfano propiamente.[5]
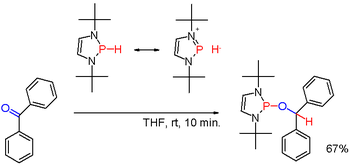
Cuando se modifica con sustituyentes adecuados como en ciertos (raros) diazafosfolenos, la polaridad del enlace P-H puede ser invertida (ver: umpolung) y el hidruro de fosfano resultante puede reducir un grupo carbonilo.[6]
Fosfanos como posible indicio de vida en otros planetas
En septiembre de 2020 se dio a conocer el hallazgo de fosfano en la atmósfera de Venus,[7] un posible indicador de actividad biológica en dicho planeta; si bien no es una evidencia definitoria respecto a la existencia de vida, sí constituye la revelación de «algo que es realmente desconocido y que podría tratarse de vida».[8][9] El descubrimiento se hizo con el telescopio James Clark Maxwell en Hawái y el Atacama Large Millimeter Array (ALMA) en Chile.[10]
Referencias
Enlaces externos
- ATSDR en Español - ToxFAQs™: fosfina
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la fosfina.