Sunitinib
Sunitinib (Handelsname: Sutent®, Hersteller: Pfizer) ist ein Rezeptor-Tyrosinkinase-Inhibitor, der als Arzneistoff zur Behandlung Erwachsener mit nicht resezierbaren und/oder metastasierten malignen gastrointestinalen Stromatumoren (GIST) zugelassen ist, wenn eine Behandlung mit Imatinib wegen Resistenz oder Unverträglichkeit fehlgeschlagen ist. Des Weiteren ist das Medikament zur Behandlung Erwachsener mit fortgeschrittenem und/oder metastasiertem Nierenzellkarzinom (RCC) und zur Behandlung nicht resezierbarer oder metastasierter, gut differenzierter pankreatischer neuroendokriner Tumoren (pNET) mit Krankheitsprogression bei Erwachsenen zugelassen.[2] Im Off-Label-Use wurde Sunitinib mit einigem Erfolg (verlängerte Überlebensdauer) bei Patienten mit fortgeschrittenem Aderhautmelanom eingesetzt.[3]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
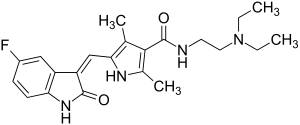 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Sunitinib | |||||||||||||||
| Andere Namen | N-[2-(Diethylamino)ethyl]-5-[(Z)-(5-fluor-1,2-dihydro-2-oxo-3H-indol-3-yliden)-methyl]-2,4-dimethyl-1H-pyrrol-3-carboxamid (IUPAC) | |||||||||||||||
| Summenformel | C22H27FN4O2 | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code | ||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 398,48 g·mol−1 | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Hintergrund
Die Entwicklung des Wirkstoffs geht auf Grundlagenforschungen von Mitarbeitern des deutschen Max-Planck-Instituts für Biochemie in Zusammenarbeit mit Partner-Institutionen in den USA in den 1980er-Jahren zurück. Ein 1991 ausgegründetes Unternehmen führte die Ergebnisse einer kommerziellen Verwertung zu, wurde bald übernommen und landete schließlich 2003 bei Pfizer. Dem Konzern gelang es 2006, eine Zulassung für das Medikament zu erhalten.[4]
Pharmakologie
Sunitinib hemmt verschiedene Rezeptor-Tyrosinkinasen. Dies sind unter anderem PDGFR, VEGFR, c-Kit, FLT, CSF und RET. Diese Rezeptoren werden mit dem Tumorwachstum, der pathologischen Angiogenese und der Entwicklung von Metastasen bei Krebserkrankungen in Verbindung gebracht.
Unter der Behandlung mit Sunitinib können als unerwünschte Wirkungen Müdigkeit, Durchfall, Hand-Fuß-Syndrom, Mundschleimhautentzündung und arterielle Hypertonie auftreten. Als Ursache für die Müdigkeit wird oft eine Schilddrüsenunterfunktion gefunden,[5][6] als deren Ursache eine verminderte Iod-Aufnahme in die Schilddrüse gilt[7] – vermutlich bedingt durch eine nicht-kompetitive Hemmung der Thyreoperoxidase.[6]
Literatur
- L. Sun, C. Liang, S. Shirazian, Y. Zhou, T. Miller, J. Cui, J. Y. Fukuda, J. Chu, A. Nematella, X. Wang, H. Chen: Discovery of 5-[5-fluoro-2-oxo-1,2- dihydroindol-(3Z)-ylidenemethyl]-2,4- dimethyl-1H-pyrrole-3-carboxylic acid (2-diethylaminoethyl)amide, a novel tyrosine kinase inhibitor targeting vascular endothelial and platelet-derived growth factor receptor tyrosine kinase. In: J. Med. Chem. Band 46, 2003, S. 1116–1119. (Synthese)
- NEJM: A. Méjean u. a.: Sunitinib Alone or after Nephrectomy in Metastatic Renal-Cell Carcinoma. In: The New England Journal of Medicine. 3. Juni 2018, doi:10.1056/NEJMoa1803675.
- NEJM: R. Motzer u. a.: Cytoreductive Nephrectomy — Patient Selection Is Key. In: The New England Journal of Medicine. 3. Juni 2018, doi:10.1056/NEJMe1806331.