Julia-Olefinierung
Bei der Julia-Olefinierung (auch Julia-Lythgoe-Olefinierung genannt) handelt es sich um eine Namensreaktion in der Organischen Chemie, die nach ihrem Entdecker dem französischen Chemiker Marc Julia benannt wurde.[1] Sie ist eine chemische Reaktion von Phenylsulfonen mit Aldehyden oder Ketonen und dient der Herstellung von Alkenen. Die Julia-Olefinierung ist neben anderen Methoden ein Standard-Verfahren zur Herstellung von Kohlenstoff-Kohlenstoff-Doppelbindungen (Carbonyl-Olefinierung).
Mechanismus
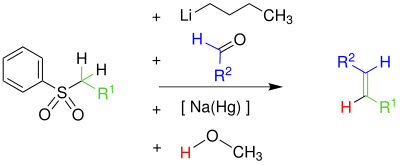
Im ersten Schritt wird das Phenylsulfon durch Butyllithium deprotoniert. Das Phenylsulfon-Anion reagiert nucleophil mit der Carbonylgruppe eines Aldehyds zu einem Alkoholat, welches in einem weiteren Schritt verestert wird. Der Ester wird mit Hilfe von Natriumamalgam [Na(Hg)] oder Samarium(II)-iodid zum Alken eliminiert.[2] Der exakte Mechanismus der Eliminierung ist unbekannt – jedoch ist davon auszugehen, dass der Mechanismus ein Radikalmechanismus unter Beteiligung eines Vinylradikals ist. Die folgende Abbildung zeigt, wie der Mechanismus nach der Literatur[3] verläuft. Alle Schritte können als Eintopf-Reaktion durchgeführt werden. Es entstehen bei dieser Reaktion bevorzugt (E)-Alkene (trans-Alkene).[4][5]
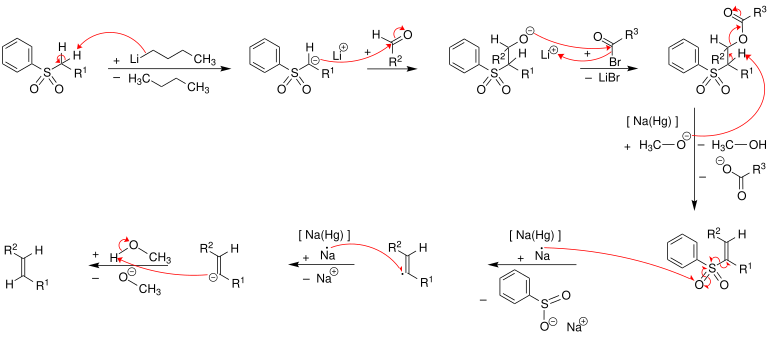
Die Konfiguration des erhalten Alkens hängt nicht von der Konfiguration des Sulfonintermediates ab und daher nimmt man an, dass sich auf der Stufe des Vinylradikals eine thermodynamisch stabile (E)-Konfiguration ausbilden kann.
Varianten
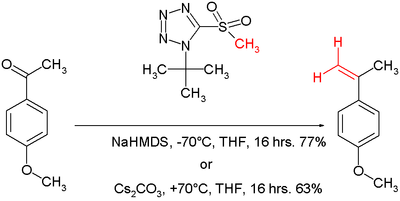
Von der Julia-Reaktion ist nach Philip Kocienski eine Variante als Julia-Kocienski-Olefinierung bekannt.[6] Das Nucleophil ist hier ein Tetrazol. Der Mechanismus ist der gleiche wie bei der Julia-Olefinierung. Die Reaktionsbedingungen können zwischen −70 °C mit Natrium-bis(trimethylsilyl)amid als Base und +70 °C mit Caesiumcarbonat als Base jeweils in THF variiert werden.[7]