Dihydrofolatreduktase
| Dihydrofolat-Reduktase | ||
|---|---|---|
 | ||
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 186 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | DHFR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.5.1.3, Oxidoreduktase | |
| Reaktionsart | Reduktion | |
| Substrat | 7,8-Dihydrofolat + NADPH + H+ | |
| Produkte | 5,6,7,8-Tetrahydrofolat + NADP+ | |
| Vorkommen | ||
| Homologie-Familie | DHFR | |
| Übergeordnetes Taxon | Lebewesen | |
Dihydrofolatreduktase (DHFR), auch Dihydrofolsäure-Reduktase, heißen Enzyme, die Folsäure zu Dihydrofolsäure (DHF) und DHF zu Tetrahydrofolsäure (THF) hydrieren. Diese Reaktionen aktivieren das Vitamin Folsäure und sind unentbehrlich für die Nukleotid-Biosynthese in allen Lebewesen. Beim Menschen kommt DHFR in allen Gewebetypen vor. Mutationen am DHFR-Gen können Dihydrofolat-Reduktase-Mangel, und dieser eine megaloblastäre Anämie verursachen.[1]
Die DHFR in Protozoen und manchen Pflanzen ist ein Doppelenzym, das zusätzlich die Funktion der Thymidylatsynthase hat; aufgrund dieser strukturellen Eigenheit ist die protozoische DHFR Target bei der Entwicklung von Antibiotika, z. B. gegen den Malariaerreger Plasmodium falciparum oder Kryptosporidien.[2][3][4]
Katalysierte Reaktionen
Quelltext bearbeiten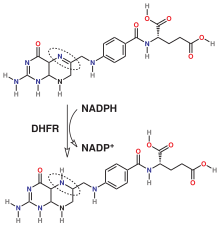
7,8-Dihydrofolsäure wird mit NADPH als Elektronendonor zu Tetrahydrofolsäure reduziert (s. Abb.). Außerdem kann Folsäure zu DHF reduziert werden; diese Reaktion läuft jedoch langsamer ab.[5][6]
Weitere Funktionen
Quelltext bearbeitenDie Anwesenheit von DHFR in Endothelzellen ist ausschlaggebend für die Funktion von Tetrahydrobiopterin in der NO-Synthase.[7]
Regulation und Hemmung
Quelltext bearbeitenDHFR ist ein ausgiebig untersuchtes Enzym, das als Target für die Chemotherapie und bei anderen Krankheiten gilt. Das Enzym kann durch Folsäure-Antagonisten wie Methotrexat, Aminopterin oder Trimethoprim kompetitiv gehemmt werden. Die Hemmung bewirkt einen Mangel an Tetrahydrofolsäure, wodurch die Thymin-Synthese (Thymidylat-Synthase benötigt THF) sowie die Purinsynthese (Aufbau des Puringrundkörpers) verhindert wird, woraufhin die Zelle abstirbt.[8]
Siehe auch
Quelltext bearbeitenWeblinks
Quelltext bearbeiten- reactome.org: Folate is reduced to dihydrofolate (DHF)
- reactome.org: DHF is reduced to tetrahydrofolate (THF)
- Proteopedia: Dihydrofolate reductase (engl.)