4-Hydroxyacetophenon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Hydroxyacetophenon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 136,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand | fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | wenig löslich in Wasser (9,9 g·l−1 bei 22 °C[3]) und in DMSO[4], sehr gut löslich in Methanol[2], Ethanol und Diethylether[4] | ||||||||||||||||||
| Brechungsindex | 1,5577 (109 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
4-Hydroxyacetophenon ist ein Phenol, das in para-Stellung eine Acetylgruppe trägt. 4-HAP kommt natürlich in vielen Pflanzengattungen vor, wo es in einer Reaktion auf Pflanzenstress über die in Pflanzen ubiquitäre Zwischenstufe Coumaroyl-CoA gebildet wird. Es wirkt u. a. als Antioxidans und findet als Ausgangsstoff für Monomere und Arzneistoffe Verwendung.
Vorkommen und Darstellung
Quelltext bearbeitenBesonders häufig tritt 4-Hydroxyacetophenon in Fichten, z. B. der Gemeinen Fichte (Picea abies)[6] – daher auch der Name Piceol – und in Artemisia-Arten, wie z. B. Artemisia herba-alba, auf und wirkt als Abwehrstoff gegen Mikroorganismen und tierische Schädlinge.
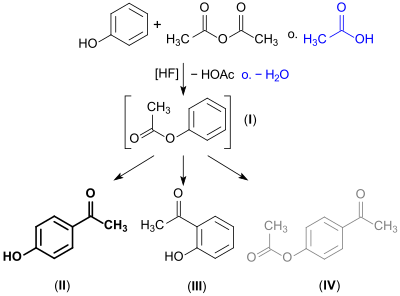
Bei der industriellen chemischen Synthese von 4-Hydroxyacetophenon reagiert Phenol mit Essigsäure oder bevorzugt mit Acetanhydrid in Gegenwart von wasserfreiem Fluorwasserstoff (HF) oder Flusssäure als Lösungsmittel und Acylierungskatalysator – anstelle des in stöchiometrischen Mengen erforderlichen und problematischen Abfall erzeugenden Aluminiumchlorids AlCl3 – zunächst unter Bildung des Esters Phenylacetat (I), der durch Fries-Umlagerung in 4-Hydroxyacetophenon (II) übergeht. Daneben werden als Nebenprodukt (< 10 %) das isomere 2′-Hydroxyacetophenon (III) und Spuren von 4-Acetoxyacetophenon (4-Acetylphenylacetat) (IV)[7] gebildet.[8]
Das Arbeiten mit HF und Flusssäure als Lösungsmittel und dessen Recycling erfordern wegen der hohen Giftigkeit und Korrosivität komplexe Prozesse und teure Apparaturen aus speziellen Werkstoffen, wie z. B. Hastelloy C-276 und Oberflächenbeschichtungen aus Fluorpolymeren, z. B. Teflon.[9]
Da das Produkt 4-HAP hartnäckig HF festhält, muss dieses durch Destillation mit z. B. n-Hexan entfernt werden.[10] Die Abtrennung von unerwünschten Verunreinigungen erfolgt mittels (mehrfacher) Umkristallisation aus z. B. Ethanol-Wasser-Gemischen.[11]
Eigenschaften
Quelltext bearbeitenReines 4-Hydroxyacetophenon ist ein weißes Kristallpulver, das sich gut in niederen Alkoholen und Diethylether löst. Angaben zum Geruch variieren zwischen geruchlos[11] und blumig.[12] Die Substanz ist leicht biologisch abbaubar und unter FEMA/GRAS # 4330 (GRAS = engl. generally recognized as safe) für den Einsatz in Lebensmitteln zugelassen.[13]
Anwendungen
Quelltext bearbeiten4-Hydroxyacetophenon besitzt oxidationshemmende, pilzabtötende und bakterienwachstumshemmende Eigenschaften[11] und wird daher zur Stabilisierung kosmetischer Zubereitungen eingesetzt.[14]
4-Vinylphenol (4-Hydroxystyrol)[15] ist durch eine mehrstufige Reaktionsfolge aus 4-Hydroxyacetophenon (II) zugänglich. Zunächst wird 4-HAP mit Acetanhydrid zu 4-Acetoxyacetophenon (IV) acetyliert. Bei der katalytischen Hydrierung von (IV) entsteht 4-Acetoxyphenylmethylcarbinol (V), das bei Erhitzen unter Wasserabspaltung in 4-Acetoxystyrol (4-Vinylphenylacetat) (VI) übergeht.[16] Abschließend kann die Acetylgruppe unter Basen- oder Säurekatalyse zum Zielprodukt 4-Hydroxystyrol (VII) hydrolysiert werden.[17]

Radikalische Polymerisation von 4-Vinylphenol erzeugt Poly(4-hydroxystyrol), das als Harzbindemittel in Photoresists verwendet wird. Da bei der Polymerisation von 4-Hydroxystyrol durch Abstraktion von Wasserstoff von der phenolischen Hydroxylgruppe Kettenabbruchreaktionen induziert und so niedrigere Molmassen und breitere Molmassenverteilungen erzeugt werden, polymerisiert man häufig die Vorstufe 4-Acetoxystyrol (VI) und entfernt anschließend die Acetylschutzgruppe durch polymeranaloge Reaktion.
Eine siebenstufige Synthese für das β-2-Sympathomimetikum Salbutamol (Albuterol) geht ebenfalls aus von 4-Hydroxyacetophenon und liefert das Racemat.[18]
Der Neurotransmitter Octopamin wird durch Reaktion von 4-HAP mit Amylnitrit oder besser tert.-Butylnitrit in Gegenwart von Chlorwasserstoff zum 4-Hydroxyisonitrosoacetophenon und nachfolgender katalytischer Hydrierung erhalten. Unter forcierten Hydrierbedingungen entsteht Tyramin, das Decarboxylierungsprodukt der Aminosäure Tyrosin.[19][20]

Eine Standardroute zum peripheren Vasodilatans Bamethan basiert ebenfalls auf 4-Hydroxyacetophenon, das zunächst durch Benzoylierung geschützt, an der Methylgruppe bromiert, mit n-Butylamin zum sekundären Amin umgesetzt und abschließend an einem Palladium-Kontakt zum racemischen Endprodukt hydriert wird.[21]

Das auch natürlich vorkommende Methylhomologe Synephrin (Oxedrin) ist in analoger Weise aus 4-HAP zugänglich, aber wegen zweifelhafter Wirkung und problematischer Nutzung obsolet.[22]
Alkylierung von 4-HAP z. B. mit 1-Brombutan erzeugt 4-Butoxyacetophenon[23], aus dem das Lokalanästhetikum Dyclonin zugänglich ist.
Das Analgetikum Paracetamol kann in einem industriellen Prozess auch aus 4-Hydroxyacetophenon durch Reaktion mit Bis(hydroxylammonium)sulfat (NH3OH)2SO4 zum Oxim und nachfolgende Beckmann-Umlagerung zum 4-Acetaminophenol (Acetaminophen) hergestellt werden.[24]

Das Verfahren erwies sich jedoch wegen hoher Investitions- und Umweltkosten (z. B. für die Entsorgung des Sulfats aus dem Hydroxylammoniumsulfat) als nicht wettbewerbsfähig. Eine im Jahr 1990 von der Hoechst Celanese Corp. in Bishop, TX in Betrieb genommene Anlage mit einer Kapazität von 9.000 Jahrestonnen wurde 2001 stillgelegt.
