Arsabenzen
Arsabenzen je organická sloučenina odvozená od benzenu náhradou jednoho uhlíkového atomu atomem arsenu, se vzorcem C5H5As.[1]
| Arsabenzen | |
|---|---|
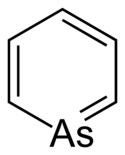 Strukturní vzorec | |
 Model molekuly | |
| Obecné | |
| Systematický název | arsinin |
| Sumární vzorec | C5H5As |
| Vzhled | bezbarvý plyn |
| Identifikace | |
| Registrační číslo CAS | 289-31-6 |
| PubChem | 136132 |
| SMILES | C1=CC=[As]C=C1 |
| InChI | InChI=1S/C5H5As/c1-2-4-6-5-3-1/h1-5H |
| Vlastnosti | |
| Molární hmotnost | 140,01 g/mol |
| Teplota tání | −54 °C (219 K) |
Některá data mohou pocházet z datové položky. | |
Jedná se o látku citlivou na vzduch,[2] která se při zahřátí rozkládá.[1] Arsabenzen je ambidentátní ligand, který může vytvářet koordinační vazby typu η1(As)- nebo η6(π).[3]
Výzkum arsabenzenu a podobných sloučenin byl důležitým krokem při výzkumu molekul obsahujících násobné vazby mezi atomy uhlíku a těžších prvků.[4]
Struktura
Molekula arsabenzenu je rovinná. Délky vazeb C—C jsou 139 pm, u vazeb As—C činí 185 Å, což je o 6,6% méně, než je u vazeb As—C obvyklé.[1]
 |
Pomocí spektroskopie nukleární magnetické rezonance lze zjistit, že arsabenzen vykazuje [[[aromatický kruhový proud|diamagnettický kruhový proud]].[6]
Příprava
Arsabenzen se připravuje dvoukrokovým postupem z penta-1,4-diynu. Diyn reaguje s dibutylstannanem za vzniku 1,1-dibutylstannacyklohexa-2,5-dienu,[1] jenž následně reaguje s chloridem arsenitým na 1-chlorarsacyklohexadien, z něhož po zahřátí odštěpením HCl vznikne arsabenzen.[1]
- CH2(CHCH)2SnBu2 + AsCl3 → CH2(CHCH)2AsCl + Bu2SnCl2
- CH2(CHCH)2AsCl → C5H5As + HCl
Reakce
Arsabenzen může být elektrofilně substituován v pozicích ortho a para; také vstupuje do Friedelových–Craftsových acylací.[2]
Přestože se pyridin obvykle neúčastní Dielsových–Alderových reakcí, tak arsabenzen se chová jako dien a reaguje s hexafluorbut-2-ynem. Do této reakce může vstoupit i fosforin při 100 °C a benzen při 200 °C. S rostoucím protonovým číslem heteroatomu se tak schopnost heterobenzenů podstoupit Dielsovy–Alderovy reakce s tímto elektrofilem zvyšuje. Bismabenzen je tak reaktivní, že vytváří rovnováhu se svým dimerem.[5]
Arsabenzen je výrazně slabší zásadou než pyridin a nereaguje s Lewisovými kyselinami; není protonován kyselinou trifluoroctovou.[5]
Odkazy
Související články
- Šestičlenné aromatické kruhy s jedním atomem uhlíku nahrazeným jinou skupinou: borabenzen, silabenzen, germabenzen, stannabenzen, pyridin, fosforin, arsabenzen, stibabenzen, bismabenzen, pyrylium, thiopyrylium, selenopyrylium, telluropyrylium
Externí odkazy
 Obrázky, zvuky či videa k tématu Arsabenzen na Wikimedia Commons
Obrázky, zvuky či videa k tématu Arsabenzen na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Arsabenzene na anglické Wikipedii.
