Valentni elektron
U hemiji i fizici, valentni elektron je elektron vanjske ljuske koja je povezana sa atomom i koja može sudjelovati u stvaranju hemijske veze ako vanjska ljuska nije zatvorena. U jednoj kovalentnoj vezi, oba atoma u vezi doprinose jednim valentnim elektrononom da bi se formirao zajednički par.

Prisustvo valentnih elektrona može odrediti hemijska svojstva elementa, kao što je valencija – da li se može povezati s drugim elementima i, ako može, koliko lahko i sa koliko. Na taj način reaktivnost datog elementa uveliko ovisi o njegovoj elektronskoj konfiguraciji. Za element glavne grupe, valentni elektron može postojati samo u najudaljenijem elektronskoj ljusci; za prijelazni metal, valentni elektron također može biti i u unutrašnjoj ljusci.
Atom sa zatvorenom ljuskom valentnih elektrona (što odgovara konfiguraciji elektrona s2p6 za elemente glavne grupe ili d10s2p6 za prijelazne metale) ima tendenciju da bude hemijski inertan. Atomi s jednim ili dva valentna elektrona više od zatvorene ljuske visoko su reaktivni, zbog relativno male energije za uklanjanje ekstravalentnih elektrona da bi stvorili pozitivan ion. Atom s jednim ili dva elektrona manje od zatvorene ljuske reaktivan je zbog svoje tendencije ili da dobije valentne elektrone koji nedostaju i stvore negativni ion, ili da dijeli valentne elektrone i tvori kovalentnu vezu.
Slično jezgru elektrona, valentni elektron ima sposobnost apsorpcije ili oslobađanja energije u obliku fotona. Energetski dobitak može pokrenuti elektron da se pomakne (skoči) do vanjske ljuske; ovo je poznato kao atomska pobuda. Ili se elektron čak može osloboditi od povezane ljuske atoma; ovo je ionizacija za stvaranje pozitivnog iona. Kada elektron izgubi energiju (uzrokujući tako emitovanje fotona), tada se može preseliti u unutrašnju ljusku koja nije u potpunosti zauzeta.
Pregled
Elektronska konfiguracija
Elektroni koji određuju valenciju – kako atom hemijski reagira – su oni s najvećom energijom.
Za element glavne grupe, valentni elektroni su definirani kao oni elektroni koji borave u elektronskoj ljusci najvišeg glavnog kvantnog broja n.[1] Dakle, broj valentnih elektrona koji može ovisiti o konfiguraciji elektrona na jednostavan način. Naprimjer, elektronska konfiguracija fosfora (P) je 1s22s22p63s23p3, tako da postoji pet valentnih elektrona (3s23p3), što odgovara maksimalnoj valenciji za P od pez. kao u molekuli PF5; ova se konfiguracija obično skraćuje u [Ne] 3s23p3, gdje [Ne] označava elektrone jezgra, čija je konfiguracija identična konfiguraciji plemenitog plina neona.
Međutim, prijelazni elementi imaju djelimično napunjene (n – 1) d nivoe energije, koji su po energiji vrlo bliski n s nivou.[2] Dakle, za razliku od elemenata glavne grupe, valentni elektron za prijelazni metal definira se kao elektron koji se nalazi izvan jezgra plemenitog plina.[3] Tako se, općenito, elektroni d u prijelaznim metalima ponašaju kao valentni elektroni, iako nisu u najudaljenijoj ljusci. Naprimjer, mangan (Mn) ima konfiguraciju 1s2 2s2 2p6 3s2 3p6 4s2 3d5. Ovo se skraćuje kao u [Ar] 4s23d5 , gdje [Ar] označava konfiguraciju jezgra, identičnu onoj u plemenitom plinu argonu. U ovom atomu 3d elektron ima energiju sličnu energiji 4s elektrona, a mnogo veću od energije 3s ili 3p elektrona. U stvari, postoji možda sedam valentnih elektrona (4s23d5) izvan jezgra sličnog argonu; ovo je u skladu s hemijskom činjenicom da mangan može imati oksidaciono stanje čak +7 (u permanganatnom ionu: MnO–
4).
Što je više desno u svakoj seriji prijelaznih metala, to je niža energija elektrona u d-podljusci i takav elektron ima manje valentna svojstva. Prema tome, iako atom nikla u principu ima deset valentnih elektrona (4s23d8), njegovo stanje oksidacije nikada ne prelazi četiri. Za cink, 3d podljuska je kompletna u svim poznatim spojevima, iako doprinosi valentnom pojasu u nekim spojevima.[4]
D elektronski broj je alternativni alat za razumijevanje hemije prijelaznog metala.
Broj valentnih elektrona
Broj valentnih elektrona elementa može se odrediti pomoću grupa periodnog sistema (vertikalni stubac) u kojem je element kategoriziran. Izuzev grupa 3 i 12 (prijelazni metali), jedinični broj grupe identificira koliko je valentnih elektrona povezanih s neutralnim atomom elementa navedenog pod tim određenim stupcem.
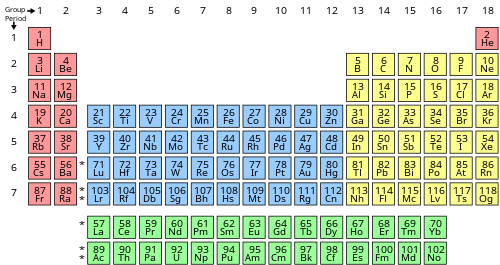
| Blok periodnog sistema | Grupa periodnog sistema | Valentni elektroni |
|---|---|---|
| s | Grupa 1 (I) (alkalni metali) | 1 |
| Grupa 2 (II) (zemnoalkalni metal) i helij | 2 | |
| f | Lantanoidi i aktinoidi | 3–16[a] |
| d | Grupe 3-12 (tranzicijski metali) | 3–12[b] |
| p | Grupa 13 (III) (borna grupa) | 3 |
| Grupa 14 (IV) (ugljikova grupa) | 4 | |
| Grupa 15 (V) (pniktogena ili dušična grupa) | 5 | |
| Grupa 16 (VI) (halkogena ili kisikova grupa) | 6 | |
| Grupa 17 (VII) (halogeni) | 7 | |
| Grupa 18 (VIII ili 0) (plemeniti plinovi) izuzev helija | 8 |
Helij je izuzetak: uprkos tome što ima konfiguraciju 1s2 s dva valentna elektrona i zbog toga ima neke sličnosti sa zemnoalkalnim metalima s njihovim ns2 valentnim konfiguracijama, njegova ljuska je potpuno puna i stoga je hemijski vrlo inertan i obično se stavlja u grupu 18, s ostalim plemenitim plinovima.
Valentna ljuska
Valentna ljuska je skup orbitala koji su energetski dostupni za prihvatanje elektrona u hemijskim vezama.
Za elemente glavne grupe, valentna ljuska sastoji se od ns i np orbitala u najudaljenijoj elektronskoj ljusci. U slučaju prijelaznih metala (orbitale (n-1) d) i lantanoida i aktinoida /(n-2) f i (n-1) d orbitale/, uključene orbitale također mogu biti u unutrašnjoj elektronskoj ljusci. Stoga je terminologija ljuska pogrešno ime jer ne postoji korespondencija između valentne ljuske i bilo koje određene elektronske ljuske u datom elementu. Naučno ispravan izraz bio bi valentna orbitala, da bi se odnosio na energetski dostupne orbitale elementa.
| Tip elementa | Vodik i helij | p-Blok (Glavna grupa elemenata) | d-Blok (Prijelazni metali) | f-Blok (Lantanoidi i aktinoidi) |
|---|---|---|---|---|
| Valentne orbitale[5] |
|
|
|
|
| Pravila brojanja elektrona | Pravilo dueta | Pravilo okteta | Pravilo 18 elektrona | Pravilo 32 elektrona |
Kao opće pravilo, glavni element grupe (osim vodika ili helija) ima tendenciju da reagira i formira konfiguraciju elektrona s2p6. Ova tendencija naziva se pravilo okteta, jer svaki vezani atom ima 8 valentnih elektrona, uključujući zajedničke elektrone. Slično tome, prijelazni metal nastoji reagirati i formirati d10s2p6 konfiguracija elektrona. Ta se tendencija naziva pravilo 18-elektrona, jer svaki vezani atom ima 18 valentnih elektrona, uključujući zajedničke elektrone.
Također pogledajte
Reference
Vanjski linkovi
- Francis, Eden. Valence Electrons.
Šablon:Elektronsko navigacijsko polje