Kobalt
Kobalt (iz latinskog cobaltum u značenju gnom, njem. kobold) jeste hemijski element sa simbolom Co i atomskim brojem 27. To je feromagnetični prelazni metal iz 9. grupe periodnog sistema. Po starijem sistemu imenovanja, ubrajao se u 8. sporednu grupu odnosno platinsko-željeznu grupu. Posebnost predstavlja atomska masa prirodnog kobalta, koja iznosi 58,93 te je tako viša od prosječne atomske mase nikla (58,69), elementa koji se nalazi nakon njega u periodnom sistemu. Ovakva posebnost također je prisutna i između argona (39,95) i kalija (39,1) kao i između telura (127,6) i joda (126,9).
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kobalt u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Kobalt, Co, 27 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Prelazni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 9, 4, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | metalnog sjaja sa plavo-sivim nijansama | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS registarski broj | 7440-48-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 0,0037[1] % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 58,933194 u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 135 (152) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 126 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | - pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Ar] 3d74s2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 15, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izlazni rad | 5,0[2] eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 760,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1648 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 3232 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 4950 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 5,0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | heksagonalna odn. kubična (prelazna temp. heks->kub: ~421 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 8900[3] kg/m3 pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | feromagnetičan | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 1768 K (1495 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 3173[4] K (2900 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 6,67 · 10−6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 390[4] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 17,2[5] kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 1768 Pa pri 4720 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 4720 m/s pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 421[1] J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 16,7 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 100 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 2, 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksid | amfoteran | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | −0,28 V (Co2+ + 2e− → Co) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 1,88 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oznake upozorenja | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: 42/43-53 S: (2-)22-24-37-61 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Historija
Rude i spojevi kobalta su poznati već veoma dugo i upotrebljavali su se pretežno za bojenje stakla i keramike (kobaltno plavo). U Srednjem vijeku, njegovi spojevi su se često smatrali vrlo vrijednim rudama srebra i bakra. Međutim, pošto su se vrlo teško obrađivali a zbog udjela arsena ispuštali su vrlo neugodne mirise, dospjeli su na "zao" glas kao "začarani". Prema legendi, gnomovi (koboldi) su pojeli vrijedno srebro a na njegovo mjesto ostavili bezvrijednu rudu boje srebra. Pored kobalta, bile su tu i rude volframa i nikla. Ove rude su kasnije rudari nazivali pogrdnim imenima poput "nikl", "volfram" (u slobodnom prevodu "vučija pjena" preko latinskog lupi spuma) pa tako i gnomova ruda (koboldova ruda) iz čega je kobalt kasnije dobio i ime.[6] Švedski hemičar Georg Brandt je 1735. otkrio ovaj, do tada nepoznat element, te mu dao današnje ime.
Osobine
Fizičke

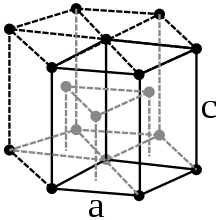
Kobalt je čelično-sivi, veoma tvrdi teški metal, gustoće od 8,89 g/cm3.[8] On je feromagnetičan sa Kirijevom temperaturom od 1150 °C[8]. Kobalt se javlja u dvije modifikacije: α-kobalt i β-kobalt. Ispod 400 °C je stabilna α-modifikacija, kristalizirana u heksagonalno-najgušćoj kristalnoj strukturi u prostornoj grupi P63/mmc i parametrima rešetke a = 250,7 pm i c = 406,9 pm, kao i dvije formulske jedinice po elementarnoj ćeliji. Na temperaturi iznad 400 °C prelazi u β-oblik kobalta sa kubičnom, plošno centriranom strukturom i parametrom rešetke a = 354,4 pm.[7]
Kao tipični metal, kobalt dosta dobro provodi toplotu i električnu struju (električna provodljivost iznosi 26% provodljivosti bakra[9]).
Hemijske
U hemijskim reakcijama sličan je željezu i niklu, pošto se stajanjem pasivizira (u prisustvu zraka). Otapa se samo u kiselinama koje djeluju oksidirajuće. Kobalt ima elektrodni potencijal od −0,277 V pa spada u neplemenite elemente. U spojevima javlja se pretežno u oksidacijskim stanjima +2 i +3. Međutim, u nekim spojevima može se javiti i u oksidacijskim stanjima -1, 0, +1, +4 i +5. Kobalt gradi veliki broj uglavnom obojenih kompleksa. Za razliku od kovalentnih spojeva, kod njega je oksidacijsko stanje +3 mnogo češće i stabilnije od stanja +2.
Izotopi

Poznato je ukupno 28 izotopa i 10 nuklearnih izomera kobalta između 47Co i 75Co. Prirodni kobalt se u potpunosti (100%) sastoji iz izotopa 59Co pa je on jedan od 22 jednoizotopskih hemijskih elemenata.[10] Ovaj izotop se može ispitati pomoću NMR spektroskopije.
Nuklid 57Co raspada se zahvatom elektrona na 57Fe. Pri prelasku na osnovno stanje jezgra-kćerke emitira gama zračenje, koje ima energije od 122,06 keV (85,6 %) i 14,4 keV (9,16 %).[11] Osnovni vid primjene izotopa 57Co je u Mössbauerovoj spektroskopiji za razlučivanje između dvo- i trovalentnog željeza.
Najdugovječniji radioaktivni izotop kobalta je 60Co (kobalt-60 sa spinom od 5+), koji ima vrijeme poluraspada od 5,27 godina a raspada se prvo beta-raspadom preko pobuđenog stanja te zatim emisijom gama-zraka (dva gama kvanta energija 1,17 i 1,33 MeV[12]) prelazi u osnovno stanje nuklida (spin 0+) koji se raspada na 60Ni (sa spinom 4+). Iz tog razloga 60Co se upotrebljava kao izvor gama zračenja za sterilizaciju ili konzerviranje namirnica kao i za ispitivanje materijala (zračenjem) i u terapijama raka ("kobaltna terapija").[13] U medicini se također mogu koristiti i drugi izotopi poput 57Co ili 58Co kao traseri.[8]
Izotop 60Co se dobija isključivo putem aktiviranjem 59Co pomoću neutrona. Kao izvor neutrona za dobijanje manjih količina služe izotopi koji se spontano raspadaju kao što je 252Cf, dok se za pravljenje većih količina koriste peleti 59Co postavljeni u tok neutrona u nuklearnim reaktorima. Nastanak izotopa 60Co iz 59Co pod dejstvom neutronskog bombardovanja može se potencijalni zloupotrijebiti i za pojačavanje djelovanja atomskog oružja, kod kojeg dolazi do emisije neutrona. Takvo atomsko oružje gdje je nuklearna bojeva glava okružena slojem kobalta naziva se kobaltna bomba. Pri detonaciji te bombe nastaju snažni gama emiteri, pa okolina postaje mnogo jače kontaminirana nego što bi bila ozračena običnom atomskom bombom.[14] Ako se izotop 60Co ne odlaže i skladišti prema propisima, nego se istopi sa običnim kobaltom te preradi u metalne proizvode i čelik, može se desiti da tako proizvedeni metalni ili čelični proizvodi budu znatno radioaktivni.[15][16]
U Wuovom eksperimentu izvedenom 1956. korišten je izotop 60Co kada je pomoću paradoksa pariteta (parnosti) otkivena sila slabe interakcije.[17]
Rasprostranjenost
Kobalt spada među relativno rijetke elemente, uz prosječnu zastupljenost u Zemljinoj kori od oko 0,004%.[1] Tako on stoji na 30. mjestu spiska najčešćih hemijskih elemenata na Zemlji.[3]
U elementarnom stanju javlja se izuzetno rijetko, samo u nekim meteoritima i, možda, u Zemljinom jezgru. Kobalt je prisutan u mnogim mineralima, ali su njegove količine uglavnom vrlo male. Često se javlja zajedno sa niklom, a ponegdje i bakrom, srebrom, željezom i uranijem. Međutim, nikl je tri do četiri puta više zastupljen od kobalta. Oba metala se ubrajaju u siderofilne elemente (po Goldschmidtovoj klasifikaciji) i karakteristični su za bazične i ultrabazične magmatite.
Kobalt, kao mikroelement (u tragovima) nalazi se u većini zemljišta. Postoji cijeli niz kobaltnih ruda u kojima se on može obogaćivati postepenim eluvijalnim i drugim procesima. Među značajnijim rudama kobalta su kobaltit (CoAsS), lineit i siegenit (poznat i kao nikl-kobaltni pijesak (Co,Ni)3S4)[18]), zatim eritrin, asbolan, skuterudit (smaltin, CoAs3) i heterogenit (CoOOH). Udio kobalta u sulfidnim rudama je relativno nizak (uglavnom do 0,1 do 0,3%[9]).
Dokazane svjetske rezerve kobalta iznose oko 25 miliona tona.[19] Najveća nalazišta ruda kobalta nalaze se u Demokratskoj Republici Kongo i Zambiji, gdje se on javlja zajedno s bakrom, a osim toga kobalta u većim količinama ima i u Kanadi, Maroku, Kubi, Rusiji, Australiji i SAD. Međutim, procjenjuje se da postoji oko 120 miliona tona kobalta u Zemljinoj kori na dnu Atlantskog, Tihog i Indijskog okeana.[19]
Dobijanje

Kobalt se pretežno dobija iz ruda bakra i nikla. Tačan proces izdvajanja i proizvodnje u velikoj mjeri zavisi od sastava polazne sirovine (rude). Najprije se dio prisutnog željezo-sulfida žarenjem pretvara u željezo-oksid te se prevodi u šljaku sa silicij-dioksidom kao željezo-silikat. Nastaje takozvana sirova stijena, koja pored kobalta i nikla, sadrži bakar i ostatke željeza kao sulfide i arsenide. Daljnjim oksidiranjem sa natrij-karbonatom i natrij-nitratom uklanjaju se daljnji ostaci sumpora. Pri tome od ostataka sumpora i arsena grade se sulfati i arsenati koji se istalože s vodom. Preostaju odgovarajući metalni oksidi koji se tretiraju sumpornom ili hlorovodičnom kiselinom. U toj fazi bakar se ne otapa, dok nikl, kobalt i željezo prelaze u rastvor. Pomoću hlornog kreča se na kraju selektivno može istaložiti kobalt u vidu kobalt-hidroksida te na taj način izdvojiti iz smjese. Njegovim zagrijavanjem nastaje kobalt(II,III)-oksid (Co3O4) a on se reducira do kobalta pomoću koksa ili praha aluminija:
Države sa najvećom proizvodnjom

|
Spojevi
U svojim spojevima, kobalt se pojavljuje uglavnom kao dvo- ili trovalentan, a njegovi spojevi često imaju vrlo izražajne boje.
Važniji spojevi su:
- Kobalt(II)-hlorid
- Kobalt oksidi, poput kobalt(II)-oksida ili kobalt(II,III)-oksida
- Kobalt(II)-nitrat
- Kobalt(II)-sulfat
- Kobalt(II)-tiocijanat
- Kobalt(II)-acetat
- Kobalt žuta
- Thénardovo modrilo
- Rinmanovo zeleno
Kompleksi

Iz rastvora kobalt(II)-hlorida dodavanjem rastvora amonijaka najprije se istaloži talog kobalt(II)-hidroksida, a ako je prisutan višak rastvora amonijaka i amonijhlorida u prisustvu zraka kao oksidacijskog sredstva nastaju različiti kompleksi aminkobalta(III). Pri tome naročito nastaju narandžasto-žuti heksaaminkobalt(III)-hlorid i crveni akvapentaaminkobalt(III)-hlorid.
Osim ovog, mogu se javiti i različiti kompleksi hloroaminkobalt(III), kao što su hloropentaaminkobalt(III)-hlorid ili dihlorotetraaminkobalt(III)-hlorid. Ovi spojevi se djelimično istalože iz rastvora. Također postoje i aminkompleksi soli kobalta(II), poput heksaaminkobalt(II)-sulfata, koji se može dobiti prevođenjem gasovitog amonijaka preko bezvodnog kobalt(II)-sulfata.
Pored aminokompleksa postoji i veći broj spojeva sa različitim ligandima. Primjeri takvih spojeva su kalijheksacijanokobaltat(II) (K4[Co(CN)6]), kalijtetratiocijanatokobaltat(II) (K2[Co(SCN)4]), kalijheksanitrotokobaltat(II) (Fišerova so, kobalt žuta), kao i kompleksi sa organskim ligandima poput etilendiamina ili oksalata.[22] Od značaja je jedna osobina kompleksa [Co(NH3)5(NO2)]Cl(NO3). Osvjetljavanjem ovog kobaltovog koordinacijskog spoja nastaju kristali veličine od nekoliko mikrometara do nekoliko milimetara, i pri nastanku "iskaču" prevaljujući udaljenosti i do 1000 puta veće od svoje veličine. Uzrok tome je izomeriziranje nitritnih liganada (NO2), koje dovodi do napona u kristalu. Ovakvo pretvaranje svjetlosne u mehaničku energiju proučavaju naučnici u Ujedinjenim Arapskim Emiratima i Rusiji.[23]
Biološki značaj
Kobalt je sastavni dio kobalamina (vitamin B12), koji je esencijalan (nezamjenjiv) za čovjeka. Čovjek može ovaj vitamin graditi direktno iz kobaltnih iona pomoću bakterija iz crijeva (crijevne flore), mada to nije dokazano. U svakom slučaju, kobalamin se u organizmu mora vezati sa intrinsičkim faktorom koji se proizvodi u želucu, a da bi se mogao apsorbirati preko završnog dijela tankog crijeva (ileuma).[24] Pošto se mjesto "proizvodnje" kobalamina u ljudskom organizmu nalazi u debelom crijevu,[25] prema mišljenju naučnika, njegova resorpcija nije moguća. Stoga je odrasloj osobi potreban dnevni unos od 0,1 μg kobalta kao mikroelementa. Nedostatak vitamina B12 može uzrokovati remećenje eritropoeze te dovesti do anemije (nedostatka krvi).[26] Kod preživara takvi nedostaci najčešće imaju uzroke u nedovoljnom unosu kobalta.[27] U industriji mesa, u hranu za životinje najčešće se dodaju vrlo male količine kobalta, ako se životinje hrane u poljima gdje nema dovoljno kobalta u zemljištu ili biljkama. Takvim dodacima u prehrani životinja također se suzbijaju i poremećaji u njihovom rastu i laktaciji, te nedostatak krvi i apetita kod životinja.[28]
Literatura
- A. F. Holleman, E. Wiberg, N. Wiberg (2007). Lehrbuch der Anorganischen Chemie (102 izd.). Berlin: de Gruyter. ISBN 978-3-11-017770-1.CS1 održavanje: više imena: authors list (link)
- M. Binnewies (2004). Allgemeine und Anorganische Chemie (1 izd.). Heidelberg: Spektrum Verlag. ISBN 3-8274-0208-5.
- Harry H. Binder (1999). Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. Stuttgart: S. Hirzel Verlag. ISBN 3-7776-0736-3.





