Stikstofmonoksied
Stikstofmonoksied is 'n chemiese verbinding van stikstof en suurstof met formule NO.
Algemeen | |
|---|---|
| Naam | Stikstofmonoksied |
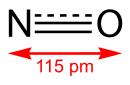 |  |
| Chemiese formule | NO |
| Molêre massa | 30,01 g/ml |
| CAS-nommer | 10102-43-9 |
| Voorkoms | kleurlose gas |
| Fasegedrag | |
| Smeltpunt | -163,6 °C |
| Kookpunt | -151,8 °C |
| Digtheid | 1,04 rel lug=1; 1,3402 g/L |
| Oplosbaarheid | 7,3% in water @ 0 °C; opl. in swaelsuur, alkohol, CS2 |
| Kritieke temperatuur | -93,15 °C |
| Henry se konstante | 1,9 x 10-3 [mol/L.atm] 1500 [K] |
Suur-basis eienskappe | |
| pKa | |
Veiligheid | |
| Flitspunt | |
| LC50 | 115 dpm (rot; 1 uur)[1] |
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Hierdie oksied is 'n kleurlose prikkelende gas wat maklik met suurstof in die atmosfeer reageer om die bruin gas stikstofdioksied (NO2) te vorm. Die diatomiese NO-molekuul het 'n onewe aantal elektrone en is 'n paramagnetiese radikaal.
Biologiese rol
Die NO-molekuul speel 'n belangrike rol in die menslike liggaam. Daar is 'n ensiem wat hierdie molekuul uit die aminosuur L-arginien vervaardig. Hierdie ensiem word byvoorbeeld in die neurone van die lugweë aangetref. NO dien as 'n boodskapper wat inligting van die een senuweesel na 'n ander oordra.[2]
Vorming en reaktiwiteit
Stikstofmonoksied word gewoonlik in die nywerheid vervaardig deur ammoniak te verbrand:
Hierdie proses vereis ongeveer 900 °C en 'n katalisator soos platinum. Die gevormde NO moet ook vinnig tot 150 °C afgekoel word om te verhoed dat N2 gevorm word.[3]
NO kan uit oksidasiereaksies van salpetersuur gevorm word:
NO kan met halogene oksohalogeniede vorm, soos:[4]
Hierdie verbinding kom ook in koningswater voor.
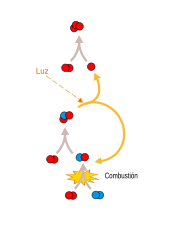
Besoedeling
NO kan in 'n binnebrandenjin ontstaan en hierdie proses is 'n belangrike bron van lugbesoedeling. Stikstofmonoksied kan in die lae atmosfeer as 'n katalisator optree in 'n fotochemiese proses wat osoon vorm. Motorvoertuie word dikwels met 'n katalisator toegerus om dit te verhoed.



