Pikriensuur
Pikriensuur is 'n organiese verbinding met die formule (O2N)3C6H2OH. Die IUSTC-naam is 2,4,6-trinitrofenol (TNP). Die Engelse naam "picric" kom van die Griekse woord πικρός (pikros), wat "bitter" beteken as gevolg van sy bitter smaak. Dit is een van die suurste fenole. Soos ander sterk genitreerde organiese verbindings is pikriensuur 'n plofstof, wat die primêre gebruik daarvan is. Dit is ook gebruik as medisyne (antiseptiese middels, behandelings vir brandwonde) en as kleurstof.
Algemeen | |
|---|---|
| Naam | Pikriensuur |
| IUSTC-naam | 2,4,6-Trinitrofenol[1] |
| Sistematiese naam | 2,4,6-Trinitrobensenol |
| Ander name | Pikriensuur[1] Karbasotiese suur Fenol trinitraat Pikrosalpetersuur Trinitrofenol 2,4,6-Trinitro-1-fenol 2-Hidroksie-1,3,5-trinitrobenseen TNP Meliniet Lyddiet |
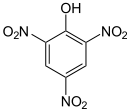 |  |
| Chemiese formule | C6H3N3O7 |
| Molêre massa | 229,10 g•mol-1 |
| CAS-nommer | 88-89-1 |
| Voorkoms | kleurlose tot wit vastestof |
| Fasegedrag | |
| Smeltpunt | 122,5 °C |
| Kookpunt | 300 °C (ontplof) |
| Digtheid | 1,763 g•cm-3 (solied) |
| Oplosbaarheid | 12,7 g•L-1 (in water) |
Suur-basis eienskappe | |
| pKa | 0,38 |
Veiligheid | |
| Flitspunt | 150 °C |
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
Sintese

Die aromatiese fenolring word geaktiveer in die rigting van elektrofiele substitusiereaksies, en poging tot nitrasie van fenol, selfs met verdunde salpetersuur, lei tot die vorming van teer, 'n polimeer met 'n hoë molekulêre massa. Om hierdie newe-reaksies te verminder, word watervrye fenol gesulfoneer met rokende swaelsuur, en die gevolglike p-hidroksifenielsulfoonsuur word dan met gekonsentreerde salpetersuur genitriseer. Tydens hierdie reaksie word nitrogroepe bekendgestel en die sulfoonsuurgroep verplaas. Die reaksie is hoogs eksotermies, en noukeurige temperatuurbeheer is nodig. 'n Ander metode van pikriensuur sintese is direkte nitrasie van 2,4-dinitrofenol met salpetersuur.[2]
Gebruike
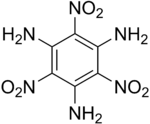
Verreweg die grootste gebruik van pikriensuur is in ammunisie en plofstof. Dunniet (ook bekend as "Explosive D"), is die ammoniumsout van pikriensuur. Dunniet is kragtiger, maar minder stabiel as die meer algemene plofbare TNT (wat geproduseer word in 'n soortgelyke proses as pikriensuur, maar met tolueen as grondstof). Pikramied, gevorm deur aminering van pikriensuur (gewoonlik word met Dunnite begin), kan verder geamineer word om die baie stabiele plofbare triaminotrinitrobenseen te produseer.
Dit het 'n mate van gebruik in organiese chemie gevind vir die bereiding van kristallynsoute van organiese basisse (pikrate) vir die identifisering en karakterisering daarvan.
Bouin-oplossing is 'n algemene oplossing wat pikriensuur bevat, wat gebruik word op histologiese monsters.[3] Dit verbeter die kleuring van suurkleurstowwe, maar dit kan ook lei tot hidrolise van enige DNS in die monster.[4] In kliniese laboratoriumtoetse word pikriensuur gebruik vir die Jaffe-reaksie om kreatinien te toets. Dit vorm 'n gekleurde kompleks wat met behulp van spektroskopie gemeet kan word. Pikriensuur vorm rooi isopurpuraat met waterstofsianied (HCN). Deur fotometriese meting van die resulterende kleurstof kan pikriensuur gebruik word om waterstofsianied te kwantifiseer.[5]
Gedurende die vroeë 20ste eeu is pikriensuur gebruik om bloedglukosevlakke te meet. Wanneer glukose, pikriensuur en natriumkarbonaat saamgevoeg en verhit word, vorm 'n kenmerkende rooi kleur. Met 'n kalibrerende glukose-oplossing kan die rooi kleur gebruik word om die toegevoegde glukosevlakke te meet. Dit staan bekend as die Lewis- en Benedict-metode om glukose te meet.[6]
Baie minder gereeld word nat pikriensuur as 'n velkleurstof of tydelike handelsmerk gebruik. Dit reageer met proteïene in die vel om 'n donkerbruin kleur te gee wat tot 'n maand kan duur. Gedurende die vroeë 20ste eeu is pikriensuur in die apteke as antiseptiese middel en as behandeling vir brandwonde, malaria, herpes en pokke aangetref. Pikrieksuur-geweekte gaas was ook algemeen in noodhulpkissies van daardie tydperk as brandbehandeling. Dit is veral gebruik vir die behandeling van brandwonde wat deur slagoffers van die Hindenburg-ramp in 1937 gely is en is ook gebruik as 'n behandeling vir verskeie kwale tydens die Eerste Wêreldoorlog.[7]
Pikriensuur word al jare lank deur vlieëvissers gebruik om molvelle en vere in donker olyfgroen te verf om as deel van vislokaas te gebruik. Dit is weens pikriensuur se toksisiteit nie baie gewild nie.
Geskiedenis
Pikriensuur is waarskynlik die eerste keer in die alchemistiese geskrifte van Johann Rudolf Glauber tevinde. Aanvanklik is dit gemaak deur die nitrasie van stowwe soos dierhoring, sy, indigo kleurstof en natuurlike hars. Pikriensuur is vir die eerste keer vanuit indigo kleurstof gesintetiseer deur Peter Woulfe gedurende 1771.[8]
Die Duitse chemikus Justus von Liebig het pikriensuur Kohlenstickstoffsäure genoem (in Frans weergegee as acide carboazotique). Pikriensuur is in 1841 deur die Franse chemikus Jean-Baptiste Dumas dié naam gegee.[9] Die sintese daarvan uit fenol en die korrekte bepaling van die formule daarvan is gedurende 1841 bewerkstellig.[10]
In 1799 het die Franse chemikus Jean-Joseph Welter pikriensuur vervaardig deur sy met salpetersuur te behandel en hy het gevind dat kaliumpikraat kan ontplof.[11] Chemici het eers in 1830 gedink om pikriensuur as 'n plofstof te gebruik. Voorheen het chemici aanvaar dat slegs die soute van pikriensuur plofbaar was, nie die suur self nie.[12][13] In 1871 het Hermann Sprengel bewys dat dit kan ontplof[14] en die militêre magte van die meeste lande het pikriensuur as hul belangrikste plofbare materiaal begin gebruik. Pikriensuur word ook gebruik in die analitiese chemie van metale, ertse en minerale.
Pikriensuur was die eerste eksplosiewe genitreerde organiese verbinding wat algemeen beskou word as geskik om die skok van afvuur in konvensionele artillerie te weerstaan. Daar was vroeër nitrogliserien en nitrosellulose (geweerkatoen) beskikbaar, maar skokgevoeligheid het soms ontploffing veroorsaak in die artillerie se loop tydens die afvuur.
In 1885 het die Franse chemikus Eugène Turpin die gebruik van gepersde en gegiete pikriensuur in ammunisie gepatenteer. In 1887 het die Franse regering 'n mengsel van pikriensuur en katoen met die naam Meliniet (in Engels, Melinite) gebruik. In 1888 het Brittanje 'n baie soortgelyke mengsel in Lydd, Kent, met die naam Lyddiet (in Engels Lyddite) begin vervaardig. Japan het gevolg met 'n verbeterde formule bekend as shimose-poeier. In 1889 is 'n soortgelyke materiaal, 'n mengsel van ammoniumkresilaat met trinitrokresol, of 'n ammoniumsout van trinitrokresol, in Oostenryk-Hongarye vervaardig. Teen 1894 was Rusland besig om ammunisie vir artillerie gevul met pikriensuur te vervaardig.
Ammoniumpikraat (bekend as Dunniet of plofstof-D) is in 1906 deur die Verenigde State gebruik. Ammunisie gevul met pikriensuur word onstabiel as die verbinding reageer met metale omhulsel of brandstof omhulsels om metaalpikrate te vorm wat makliker ontplof as pikriensuur. Die sensitiwiteit van pikriensuur is getoon deur die Halifax-ontploffing.
Pikriensuur is gebruik in die Slag van Omdurman,[15] die Tweede Boereoorlog,[16] die Russies-Japannese Oorlog,[17] en die Eerste Wêreldoorlog.[18]
In 1902 het Duitsland artillerie-ammunisie met trinitrotolueen (TNT) begin vul. Tolueen was minder beskikbaar as fenol, en TNT is minder kragtig as pikriensuur, maar verbeterde veiligheid van die vervaardiging en opberging van ammunisie het veroorsaak dat pikriensuur deur TNT vervang is vir die meeste militêre doeleindes tussen die Wêreldoorloë.[15]
Veiligheid
Moderne veiligheidsmaatreëls beveel aan dat pikriensuur nat geberg word om die ontploffingsgevaar te beperk. Droë pikriensuur is relatief sensitief vir skok en wrywing, en laboratoriums wat dit gebruik, stoor dit in bottels onder 'n laag water, wat dit veilig maak. Glas- of plastiekbottels word benodig, aangesien pikriensuur maklik metaalpikraat-soute kan vorm wat selfs meer sensitief en gevaarliker is as die suur self. In die bedryf is pikriensuur veral gevaarlik omdat dit vlugtig is en stadig sublimeer selfs teen kamertemperatuur. Met verloop van tyd kan die opbou van pikrate op blootgestelde metaaloppervlaktes 'n ontploffingsgevaar inhou.[19]
Pikrieksuurgaas, indien dit in antieke noodhulpkissies gevind word, hou 'n veiligheidsgevaar in omdat oud pikriensuur gekristalliseer en onstabiel geword het en moontlik metaalpikrate gevorm het uit lang opberging..
Bomverwyderingseenhede word opgeroep om pikriensuur te verwyder as dit uitgedroog het.[20][21]
Ammunisie wat pikriensuur bevat, kan in gesinkte oorlogskepe voorkom. Die ophoping van metaalpikrate oor tyd maak dit skokgevoelig en uiters gevaarlik. Dit word aanbeveel dat skeepswrakke wat sulke ammunisie bevat, geensins versteur word nie. Die gevaar kan afneem wanneer die skulpe korrodeerend genoeg is om seewater toe te laat, aangesien hierdie materiale wateroplosbaar is.[22]
In Suid-Afrika
In 2013 in Welbekend, Tshwane is een plaaswerker dood en twee ernstig beseer toe 'n bom, wat hulle met 'n asetileenfakkel probeer oopsny het, ontplof het. Die bom is na die groep gebring deur 'n man en 'n vrou wat dit op 'n vullishoop in die omgewing gevind het. Tshwane-nooddienste se bronne het bevestig dat hulle na die toneel ontbied is om die gebied te ontsmet nadat 'n ongeïdentifiseerde geel poeier, wat glo pikriensuur is, oor die ontploffingsterrein versprei het.[23]